
|
||
|
|
||
|
|
Онлайн книга - Трещина в мироздании | Автор книги - Сэмюел Стернберг , Дженнифер Даудна
Cтраница 35

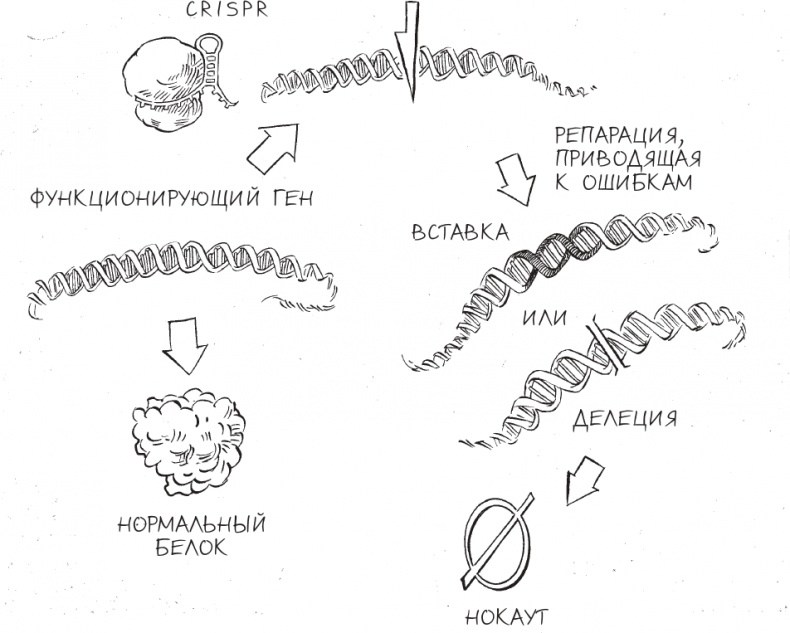
Нокаут генов с помощью CRISPR Когда специалисты по генетике животных начинали использовать CRISPR, они собирались создать четко проявляющие себя генные нокауты. Одной из их излюбленных мишеней был ген под названием TYR. Он возник более полумиллиарда лет назад и широко распространен среди животных, растений и грибов; этот ген кодирует белок тирозиназу, участвующий в процессе синтеза меланина – важного пигмента. Мутации TYR у людей приводят к недостаточности тирозиназы и вызывают кожно-глазной альбинизм I типа – генетическое нарушение, для которого характерны дефекты зрения, бледная, слабо пигментированная кожа и красные глаза. Если CRISPR запрограммировать на редактирование мышиной версии гена TYR, то вызовет ли его действие альбинизм у мышей? В 2014 году коллектив ученых из Техасского университета спроектировал версию CRISPR, атакующую двадцатибуквенную последовательность ДНК в гене TYR, и ввел ее в оплодотворенные мышиные яйцеклетки [86]. Развившиеся из них грызуны поразили ученых: хотя все их родители имели шерстку нормального темного цвета, многие мышата родились с красными глазами и абсолютно белой шкуркой. Такой результат можно было объяснить только мутациями в ДНК, нарушившими дешифровку гена TYR. Изменение цвета кожи, шерсти и глаз мышей было именно таким четким признаком нокаутирования гена, как того и хотели исследователи. Хотя по результатам секвенирования ДНК всегда можно подтвердить факт редактирования генома, прелесть использования гена TYR в качестве мишени заключалась в том, что ученые могли увидеть результаты своих экспериментов воочию. Простой подсчет числа черных (тех, у которых редактирования генома не произошло) и белых (тех, чей геном оказался отредактирован) мышат дал удивительно точную оценку эффективности CRISPR. Кроме того, аналогичным способом можно было следить за изменением этой эффективности во времени, по мере того как в различных лабораториях оптимизировали строение и создание CRISPR-систем. В работе техасцев только 11 % потомства родителей, чьи зиготы были отредактированы, были полными альбиносами, и немалое количество мышат на фотографиях этих пометов были черно-белыми – и порой черного у них в шерсти было заметно больше, чем белого. Не прошло и года, как исследовательский коллектив из Японии повторил эти эксперименты с минимальными изменениями методики и добился эффективности в 97 % [87]: шерсть тридцати девяти из сорока мышат сияла белизной, а пигментов в радужке не было. Всего за несколько недель ученые точно заданным образом навсегда изменили генофонд целого поколения мышей (и всех их будущих потомков) – таким образом, каким это никогда не задумывала природа. Генные нокауты – лишь один из множества подходов к редактированию генома, которые ученые довели до совершенства с помощью CRISPR. Нередко генным инженерам требуется нечто более точное, чем неспецифическое внедрение мутаций в ген за счет случайных вставок или делеций нуклеотидов ДНК. В конце концов, главная цель редактирования генома, по крайней мере применительно к медицине, – это избавление от генетических заболеваний, абсолютное большинство которых вызывается мутациями, “выключающими” важные гены. В таких случаях генные нокауты не принесут пользы, так как у них уже есть неработающие гены – и именно они служат причиной проблем со здоровьем. Что необходимо ученым, так это способ выявлять отдельные ошибочно расположенные “буквы” ДНК, редактировать их и таким образом приводить состав генов в норму. К счастью, клетки имеют молекулярные машины для осуществления второго типа репарации клеток, гораздо более точного и лучше поддающегося контролю, чем простое склеивание фрагментов разорванной ДНК. Вместо соединения отрезков ДНК, последовательности нуклеотидов в которых никак не связаны друг с другом, этот второй вариант репарации – цепь биохимических реакций, которую пионеры редактирования генома использовали в своих целях, – соединяет только отрезки ДНК, последовательности нуклеотидов которых частично совпадают. По причине такой избирательности процесс называют двумя синонимичными терминами: гомологичная рекомбинация и репарация, направляемая гомологией. Гомологичная рекомбинация сходна с процессом сборки панорамного снимка из трех частично перекрывающихся фотографий. Чтобы в итоговом изображении они составляли единое целое, фотографу нужно правильно наложить бока центральной фотографии на правую сторону фото слева и левую сторону фото справа. Если середина панорамы вырезана или повреждена, фотографу достаточно взять дубликат центрального снимка и по описанному принципу восстановить панораму. А если изображаемый пейзаж в реальности изменился – например, там построили новый дом или срубили большое дерево, – фотограф в состоянии справиться и с этой ситуацией. Для этого ему нужно вставить новое центральное изображение взамен старого, используя тот же самый подход. Получается, что ферменты внутри клетки выполняют аналогичные операции вырезания и вставки, но вместо панорамы у них ДНК. Способ репарации, о котором мы уже говорили, – соединение концов, иногда приводящее к ошибкам в последовательности нуклеотидов, – применяется, когда клетка сталкивается с такой серьезной и неотложной проблемой, как разорванная хромосома, и “на авось” заново соединяет разрезанные концы – подобно тому как фотограф склеивает панораму, в которой не хватает кусочка пейзажа. Однако когда у клетки есть и разорванная хромосома, и второй фрагмент ДНК, совпадающий с двумя разъединенными концами, – шаблон для починки, по функциям напоминающий дубликат центрального снимка из примера выше, – она выбирает лучший вариант: вставить фрагмент ДНК в разорванную хромосому, но таким образом, чтобы он без шва наложился на соответствующие концы. При реализации такой стратегии вредоносную генетическую мутацию в точке, куда нацелен CRISPR (или в непосредственной близости от нее), можно навсегда устранить, заменив новой, “здоровой” последовательностью ДНК. Пока исследователи снабжают клетку CRISPR шаблоном для репарации, последовательность которого совпадает с таковой для поврежденного гена, клетка будет добросовестно использовать выданные ей запчасти для устранения повреждений. 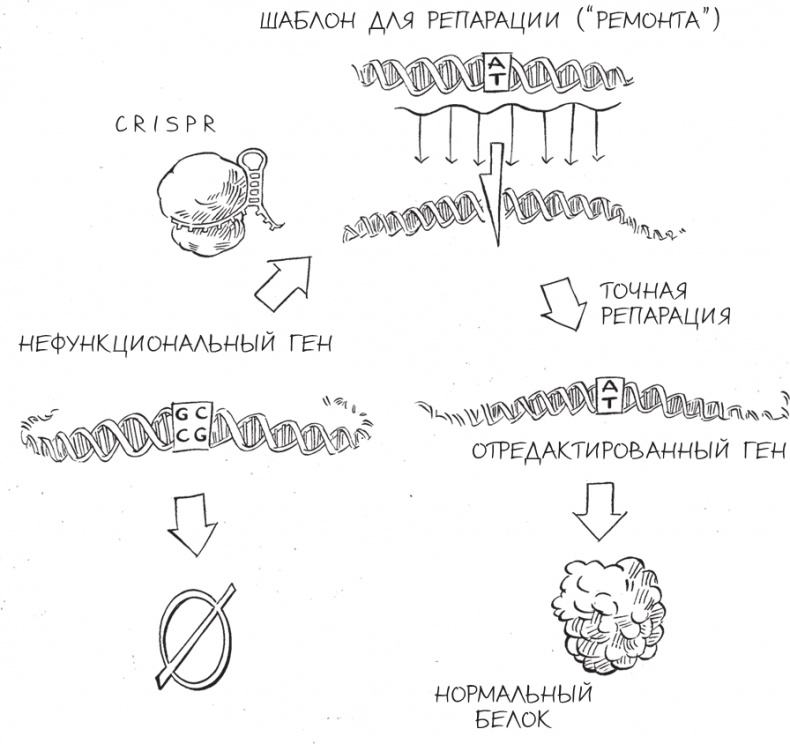
Гомологичная рекомбинация с CRISPR Помимо тонкой настройки генов путем “небрежной” (негомологичной) или точной (гомологичной) репарации, ученые приспособили CRISPR для вырезания или переворачивания больших фрагментов ДНК, что позволяет изменять гораздо более крупные участки генома. В рамках этого метода используется готовность клеток “пойти на все”, лишь бы восстановить целостность хромосомы. Вооружив Cas9 двумя разными направляющими РНК, исследователи могут запрограммировать CRISPR на разрезание хромосомы в двух соседних генах; клетка справляется с этим повреждением, собирая хромосому заново по одному из трех сценариев.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно