
|
||
|
|
||
|
|
Онлайн книга - Трещина в мироздании | Автор книги - Сэмюел Стернберг , Дженнифер Даудна
Cтраница 32

Ключевая особенность этого процесса репарации – заложенная в самой его природе небрежность. Как сварщик перед работой должен удостовериться, что у обеих труб очищены торцы, подлежащие сварке, так и клетке перед соединением фрагментов разорванной ДНК тоже нужно убедиться, что концы этих фрагментов чистые. Создание чистых концов иногда требует удаления или вставки нескольких “букв” ДНК, что приводит к изменениям состава генов после окончания процесса репарации. Это означает, что ген, скорее всего, изменится после “атаки” и вырезания его CRISPR и последующей починки за счет клетки. Этот неточный и порождающий ошибки способ репарации должен был обеспечить нам с Мартином простой метод выявления успешных попыток редактирования генов. Выбирая в качестве мишени конкретный ген и анализируя последовательность его нуклеотидов буква за буквой до воздействия CRISPR и после него, мы могли бы найти любой признак неаккуратной репарации, а это доказало бы, что CRISPR обнаружил свою цель и разрезал ее. Мы с Мартином решили запрограммировать CRISPR таким образом, чтобы он атаковал человеческий ген, который называется ген легкой цепи клатрина A (CLTA) и задействован в эндоцитозе – процессе, который клетки используют для захвата питательных веществ и гормонов. Мы не изучали эндоцитоз, но ген CLTA уже был отредактирован по более старой технологии ZFN в лаборатории профессора Дэвида Друбина, которая тоже находится в Беркли. Поэтому мы знали, что редактирование этого гена возможно, а тестирование CRISPR на материале, на котором уже изучали ZFN, помогло бы нам выявить сходства и различия действия двух методов. Конечно, создание инструмента на основе ZFN для редактирования CLTA требовало нескольких месяцев работы и тесного сотрудничества с компанией, бесплатно предоставившей команде Дэвида ZFN (в то время разработка одного ZFN стоила непозволительно дорого – 25 000 долларов). В случае Мартина все было совсем иначе: ему потребовалось всего несколько минут, чтобы смоделировать на компьютере аналогичный [81] вариант CRISPR, и синтезировать нужные молекулы можно было за несколько десятков долларов. В конце концов, это и есть одно из главных преимуществ CRISPR – то, что вам фантастически легко указывать в качестве мишени определенные гены. Все, что нужно было сделать, – выбрать желаемую двадцатибуквенную последовательность ДНК для редактирования и затем перевести ее в соответствующий двадцатибуквенный код РНК. Когда эта РНК окажется в клетке, она соединится с подходящей последовательностью ДНК по принципу комплементарности, и Cas9 разрежет ДНК. Экспериментальной площадкой для нашего первого испытания редактирования генома должны были стать клетки линии HEK 293. Впервые полученные в 1973 году из клеток почки абортированного плода, клетки HEK 293 снискали популярность среди специалистов в клеточной биологии благодаря простоте их культивирования в лаборатории и тому, насколько легко они принимали в себя чужеродную ДНК. Когда мы смешали две плазмиды (одну – с генетическими инструкциями по производству Cas9 и вторую – с генетическими инструкциями по сборке направляющей РНК) в маслянистом растворе молекул, которые называются липидами, то мини-хромосомы (плазмиды) стали спонтанно захватываться жировыми пузырьками, очень похожими на капли жира на поверхности куриного бульона. После того как мы добавили эту смесь к культурам клеток HEK 293, жировые пузырьки должны были слиться с клеточными мембранами и выбросить содержащуюся в них ДНК внутрь клеток. Оказавшись в клетке, ДНК подверглась бы копированию, транскрипции и трансляции, в результате чего получатся белок Cas9 и направляющая РНК, специфически связывающая ген CLTA. Разрезающий ДНК аппарат должен был затем транспортироваться внутрь ядра, где находились наши целевые последовательности ДНК. Мы предполагали, что он найдет правильную двадцатибуквенную последовательность ДНК и разрежет ее. А клетка починит поврежденную ДНК таким образом, что мы это заметим. Эксперименты Мартина тут же продемонстрировали, что мини-хромосомы действительно давали клеткам человеческой почки возможность производить компоненты CRISPR. Когда Мартин изучал эти клетки под микроскопом, он увидел, что значительная доля клеток светилась зеленым, что могло получиться только в результате образования Cas9, связанного с зеленым флуоресцентным белком. Собрав часть клеток и превратив их в кашицу для анализа различных содержащихся в них молекул РНК, Мартин также обнаружил, что клетки почки производили солидные количества направляющей РНК. Перенос CRISPR из бактериальных клеток в человеческие сработал так, как мы ожидали, но оставался один резонный вопрос: редактирует ли CRISPR ДНК человека? Мартин и Александра Ист-Селетски, молодая студентка, недавно присоединившаяся к проекту, измельчили еще некоторое количество клеток, выделили из них ДНК и проанализировали состав гена CLTA. Ошибки быть не могло: ген был отредактирован именно на участке, точно совпадающем с последовательностью направляющей РНК. Для неспециалиста результаты не выглядели впечатляющими – какие-то темные полоски на тонкой пластинке гелеподобного материала, – однако выводы из этих “полосок” и потенциальные применения этих выводов имели грандиозное значение. Всего в несколько простых и хорошо отработанных стадий мы с Мартином выбрали произвольную последовательность ДНК в состоящем из 3,2 миллиарда “букв” геноме человека, спроектировали вариант CRISPR для ее редактирования и стали наблюдать, как крохотная машинерия выполняла то, на что была запрограммирована, – и не где-нибудь, а в живых человеческих клетках. Своими результатами мы подтвердили работу новой технологии, дающей ученым удивительную способность переписать код жизни с хирургической точностью и поразительной простотой. В мгновение ока CRISPR по своему развитию догнал технологии редактирования генома, исследование и разработка которых шли почти двадцать лет. 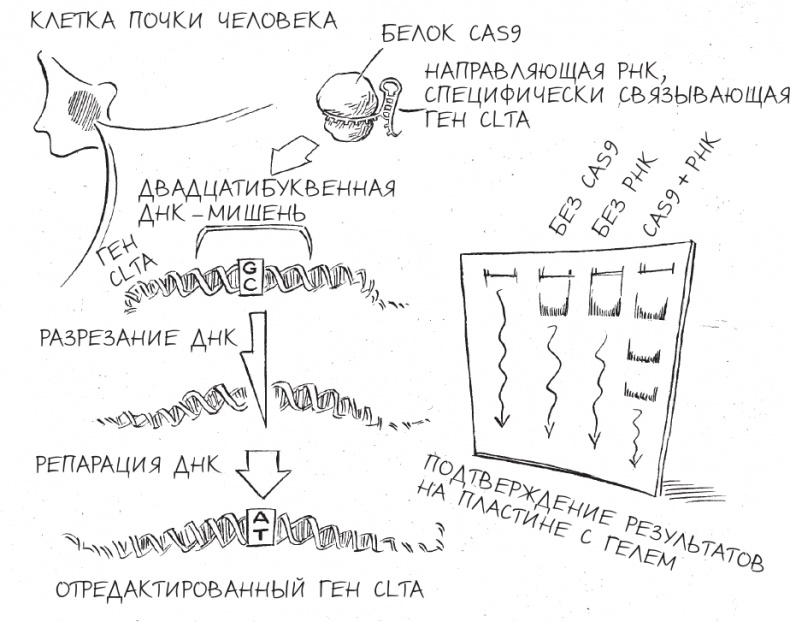
Редактирование ДНК в человеческих клетках c помощью CRISPR Фактически в такой же спешке, как и шестью месяцами ранее, когда мы готовили публикацию с Кшиштофом и Эммануэль, мы написали текст научной статьи с изложением наших новейших результатов. Если наша первая публикация 2012 года содержала прямое указание на то, что CRISPR следует применить в качестве новой платформы редактирования генома в клетках, то во второй статье уже содержались четкие демонстрация и подтверждение внушительных возможностей этой недавно открытой системы. Когда 2012-й подходил к концу, я ощущала заметную иронию, читая, что журнал Science, опубликовавший нашу статью о CRISPR всего за полгода до этого, поставил редактирование генома на вторую строчку списка прорывов года (первое место отдали бозону Хиггса), но упомянул в этом пункте более старую технологию, TALEN, открытую непосредственно перед началом нашей работы с CRISPR. Мне было интересно, какие еще сюрпризы CRISPR преподнесет научному сообществу. К моему глубокому удовлетворению, первые две недели 2013 года ознаменовались публикацией еще пяти научных статей о CRISPR (не считая нашей) [82], и все они описывали сходные эксперименты, в которых эту систему применяли для редактирования генов непосредственно в клетках – как мы и предсказали в 2012-м. И профессор МТИ Фэн Чжан, и гарвардский профессор Джордж Чёрч предварительно связывались со мной, чтобы сообщить о готовящихся публикациях. Статьи Чжана и Чёрча появились на сайте журнала Science в начале января, а чуть позже в том же месяце вышли и наша с Мартином статья, и три другие за авторством профессора Джин Су Кима из Сеульского национального университета, профессора Рокфеллеровского университета Лучано Марраффини и профессора Гарвардской медицинской школы Кита Джоунга.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно