
|
||
|
|
||
|
|
Онлайн книга - Трещина в мироздании | Автор книги - Сэмюел Стернберг , Дженнифер Даудна
Cтраница 21

Основываясь на работе Болотина, Родольф и Филипп спланировали эксперименты для проверки этого предположения. Действительно ли штамм S. thermophilus способен повышать свою устойчивость к конкретному бактериофагу, вставляя себе в область CRISPR новые фрагменты ДНК, совпадающие с последовательностями ДНК этого фага? В своих опытах исследователи из Danisco сосредоточились на штамме S. thermophilus, который широко используется в молочной промышленности, и на двух вирулентных фагах, выделенных из образцов фабричного йогурта. Основой методики послужили простейшие генетические эксперименты – подобные проводили с начала XX столетия. Ученые заражали популяции бактерий в отдельных пробирках двумя фагами, инкубировали их 24 часа, а затем проверяли, остались ли в этих культурах живые бактерии, высевая их в чашки Петри и оставляя их на ночь расти. Было обнаружено, что, хотя фаги уничтожили более 99,9 % бактерий, девять новых, мутировавших штаммов S. thermophilus, видимо, были устойчивы к заражению фагами. В этой части исследования Danisco не было ничего принципиально нового, поскольку другие ученые тоже использовали сходные методы для обнаружения резистентных к фагам штаммов S. thermophilus. Но Родольф и Филипп пошли дальше. Они попытались выяснить, что именно на уровне генов обеспечивает бактериям эту наблюдаемую неуязвимость. У Родольфа и Филиппа была одна догадка по поводу того, какая часть бактериального генома делала мутировавшие штаммы S. thermophilus устойчивыми к заражению вирусами: они подозревали, что за это отвечает CRISPR, и предполагали, что участки CRISPR у девяти новых мутантных штаммов по строению отличаются от таковых у предкового штамма. И действительно: выделив геномную ДНК из каждого мутантного штамма, исследователи обнаружили, что каждая область с CRISPR расширилась за счет вставки новых кусочков ДНК между повторами. Более того, эти новые спейсеры точно повторяли последовательности ДНК фага, к которому конкретный штамм приобрел иммунитет. Особенно примечательным казалось следующее: благодаря физическому встраиванию в область CRISPR бактериальной ДНК новоприобретенная устойчивость наследовалась и могла передаваться всем последующим поколениям при каждом делении. Исследователи из Danisco обнаружили еще один способ борьбы бактерий с вирусами – их пятый набор вооружения. Как мы теперь знаем, в дополнение к ранее открытым системам защиты у бактерий имеется (в виде CRISPR) удивительно эффективная система противовирусного адаптивного иммунитета, позволяющая “воровать” кусочки ДНК фагов, когда последние заражают бактерии, и использовать их для обеспечения иммунного ответа в будущем. По выражению Блейка, CRISPR работал как “молекулярная карта” профилактических прививок: сохраняя память о предыдущих фаговых инфекциях в форме спейсерных последовательностей ДНК, запрятанных в рядах из повторов и спейсеров, бактерии могли использовать эту информацию для распознавания и разрушения тех же самых фагов во время новых столкновений с ними. 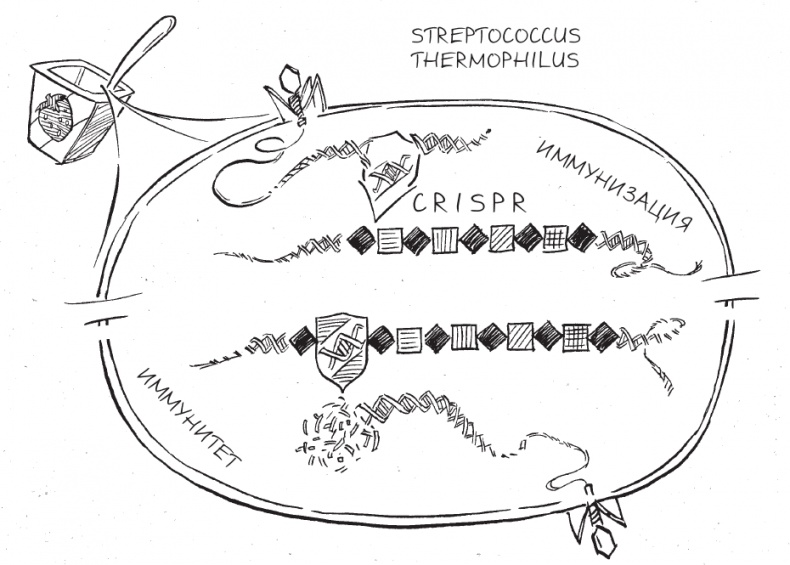
CRISPR: молекулярная карта профилактических прививок С момента публикации исследования Danisco малопонятная биология CRISPR начала привлекать внимание исследователей. Кроме того, эта статья стала поводом для проведения первой посвященной CRISPR встречи, которая состоялась в Калифорнийском университете в Беркли в 2008 году и была организована Джилл Бэнфилд и Родольфом Баррангу. Однако, как это всегда бывает в науке, исследователи приоткрыли одну дверь, чтобы обнаружить за ней другую. Поскольку для иммунного ответа CRISPR требуется, чтобы последовательности ДНК в вирусном и бактериальном геноме полностью совпадали, было понятно, что эта иммунная система “целится” в генетический материал фагов, чтобы разрушить его, – но как? Какая составляющая клетки наводилась на цель? Прошло не так уж много времени, и начал вырисовываться ответ и на этот вопрос. Стэн Броунс, постдок из лаборатории Джона ван дер Ооста в Вагенингенском университете в Нидерландах, предоставил убедительное доказательство того, что молекулы РНК задействованы в основанной на CRISPR защите от вирусов [63]. Стэн опирался на более раннее исследование, в ходе которого были обнаружены молекулы РНК, в точности совпадающие с последовательностью ДНК CRISPR в клетках архей различных видов [64] (включая обитающие в вулканах штаммы Sulfolobus, которых изучал Блейк). Это позволило предположить, что РНК может координировать в иммунном ответе стадии распознавания и разрушения фагов. А Стэн, экспериментируя с E. coli, добавил к этим наблюдениям новые сведения, подтвердив, что РНК играет эту роль в основанной на CRISPR системе защиты у совершенно иного микроорганизма, – и это послужило хорошим аргументом в пользу того, что РНК необходима для всех связанных с CRISPR иммунных систем. Стэн также показал, каким образом в клетке синтезируются молекулы РНК CRISPR. Сначала бактериальная клетка “переводит” весь ряд элементов CRISPR в длинные цепочки РНК, с точностью до буквы совпадающие с последовательностью нуклеотидов в ДНК CRISPR (как мы помним, РНК – молекула-сестра ДНК, состоящая из тех же “букв”, с той только разницей, что “буква” Т в ДНК в РНК заменяется на У). Как только клетка синтезирует эти длинные цепочки РНК на основе CRISPR, фермент с хирургической точностью разрезает их на более короткие РНК одинаковой длины, единственное отличие между которыми – последовательности нуклеотидов в их спейсерах. В ходе этого процесса длинные повторяющиеся последовательности ДНК переводятся в библиотеку из более коротких молекул РНК, каждая из которых содержит одну последовательность, построенную на основе фрагмента генома конкретного фага. Эти данные указали на ключевую роль, которую РНК CRISPR играет в бактериальной иммунной системе, – и для этой роли РНК идеально подходит. Поскольку РНК химически очень похожа на ДНК, она также может образовывать двойные спирали за счет комплементарных взаимодействий азотистых оснований (которые лежат и в основе знаменитой двойной спирали ДНК) [65]. Подходящие (комплементарные) цепочки РНК могут взаимодействовать друг с другом, формируя двойную спираль РНК – РНК, но и одна цепочка РНК способна соединяться с подходящей одиночной цепочкой ДНК с образованием двойной спирали РНК – ДНК. Эта вариабельность и многообразие последовательностей, обнаруженных в РНК CRISPR, подсказали ученым заманчивую идею. Казалось возможным, что молекулы РНК CRISPR способны “вывести из игры” ДНК и РНК фагов-интервентов, образуя пары с любыми из них, подходящими по последовательности нуклеотидов, и запуская в клетке некий иммунный ответ.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно