
|
||
|
|
||
|
|
Онлайн книга - Карнавал молекул | Автор книги - Михаил Левицкий
Cтраница 37

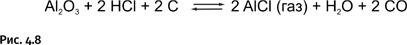
Побочный продукт – вода – мог бы гидролизовать образовавшийся AlCl, но «не успевает» это сделать, поскольку при высокой температуре реагирует с углеродом, образуя два газа СО и СН4 (рис. 4.9). 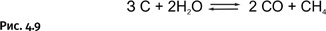
AlCl (газообразный при высокой температуре) перемещается в более холодные области на поверхности Земли и затем перегруппировывается, образуя металлический алюминий и хлорид алюминия AlCl3 (рис. 4.10). 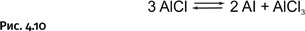
Фактически проходит окислительно-восстановительная реакция между атомами алюминия: из Al+ образуются Al0 и Al3+, всю показанную схему удалось подтвердить экспериментально. При перемещении из горячей зоны в холодную летучий AlCl играет роль «перевозчика алюминия». Со временем были найдены и другие «транспортные средства». От наблюдения к открытию
В конце XIX в. достоинства металлического никеля (рис. 4.11), такие как механическая прочность в сочетании с коррозионной устойчивостью и жаропрочностью, были хорошо известны. Никель применяли для изготовления заводской аппаратуры и для покрытия металлической посуды. Однако коррозионная устойчивость никеля в бытовых условиях оказалась невысокой. Нагревание такой посуды на огне приводило к постепенному ее разрушению, которое долгое время объясняли коррозией, протекающей при повышенной температуре. Те, кто был более наблюдателен, замечали, что при нагревании этой посуды на раскаленной плите (без контакта с пламенем) коррозия не наблюдалась. Следовательно, кислород и влага воздуха ни при чем. Оказалось, что все дело в контакте никеля с монооксидом углерода СО, который всегда присутствует в открытом пламени. Окончательную ясность внес английский химик и промышленник Л. Монд (1839–1909), изучавший процессы коррозии никелевой аппаратуры в заводских условиях. Он обратил внимание, что при сжигании смеси Н2 и СО пламя было ярко окрашено только в том случае, когда смесь газов подавали через никелевую трубку. Выяснилось, что никель взаимодействует с СО, образуя легколетучее соединение – карбонил никеля Ni(CO)4. Это открытие вызвало интенсивный поток работ, в результате которых были получены карбонилы многих металлов. Возник новый раздел химической науки – химия карбонилов металлов. Кроме того, карбонил никеля подсказал химикам еще одно направление исследований. 
Простое взамен громоздкого
Очистка металлов от примесей всегда была делом трудоемким, и потому химики постоянно искали простые и удобные способы, позволяющие отделять металл от загрязнений. Основной источник металлического никеля – сульфидные руды, в которых содержатся также примеси сульфидов кобальта и железа (CoS, FeS и др.). Ранее для получения никеля в промышленности поступали следующим образом: медно-никелевую руду вместе с флюсами (веществами, снижающими температуру плавления) плавили в электропечах. Железо отделяли, окисляя его, т. е. продувая расплав воздухом в специальных емкостях (конвертерах). Оставшийся расплав сульфидов никеля, меди и кобальта охлаждали, мелко измельчали и направляли на флотацию (разделение твердых частиц, основанное на их различной смачиваемости водой, содержащей добавки вспенивателей). Таким способом отделяли медные и кобальтовые сульфиды от никелевых. Далее полученный концентрат сульфида никеля обжигали, при этом получали оксид никеля NiO, а сера удалялась в виде газообразного оксида. Затем полученный оксид никеля восстанавливали в электродуговых печах, и в результате получали металлический никель. Как видим, процесс громоздкий и трудоемкий. Карбонил никеля открыл другой, более короткий путь. Он основан на том, что Ni(CO)4 – необычайно летучее вещество (tкип. = 43 °С). После обработки смеси сульфидов монооксидом углерода СО под давлением образуется карбонил никеля, который можно легко отогнать (карбонилы остальных металлов гораздо более труднолетучи) (рис. 4.12). 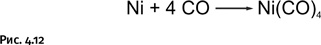
При последующем нагревании до 180 °С полученный карбонил легко разлагается, образуя металлический никель высокой степени чистоты. Транспортные реакции в промышленности и у нас дома
Итак, основной замысел – очистка металла путем перевода его в летучее соединение. Естественно, эту идею постарались применить и к другим металлам. Необходимо было, чтобы металлы сравнительно легко образовывали летучие соединения. Удачные варианты были найдены: при пониженных температурах иод легко реагирует с такими металлами, как титан, цирконий, гафний и др. Полученные иодиды можно легко отогнать, затем при нагревании они разлагаются, образуя чистый металл. Освободившийся иод может быть вновь направлен на взаимодействие с очередной порцией очищаемого металла. Реакции такого типа называют транспортными, роль транспортного средства играет, естественно, иод (рис. 4.13). Способности иода в роли «перевозчика» широки: он реагирует при 1100 °С с элементарным кремнием, образуя летучий SiI4 (рис. 4.14). 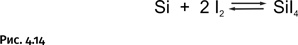
На этом превращения не завершаются, при высокой температуре более устойчивы соединения кремния со степенью окисления два, поэтому получившийся SiI4 реагирует с имеющимся элементарным кремнием, образуя SiI2 (рис. 4.15). 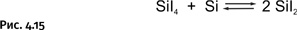
Как и в случае с алюминием, окислительно-восстановительная реакция проходит между атомами кремния, только в обратном, нежели у алюминия, направлении: из Si4+ и Si0 получается Si2+. Если образовавшийся газообразный SiI2 направить в холодную зону, то он окажется в условиях, где более устойчивы соединения Si4+, в результате пойдет реакция, обратная той, что показана выше (рис. 4.16). 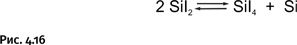
В холодной зоне останется элементарный кремний (естественно, высокочистый), а SiI4 можно вновь направить в горячую зону. Потребность в чистом кремнии высока, его используют для изготовления компьютерных процессоров и солнечных батарей. Чем отличаются процессы очистки металлов и кремния? В конечном итоге чистые металлы получают при термическом разложении летучих иодидов, а элементарный кремний, наоборот, образуется в охлаждаемой зоне. Впрочем, для кремния существует и вторая возможность. Если получившийся при 1100 °С SiI2 нагреть еще выше (до 1400 °С), он распадется на Si и I2.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно