
|
||
|
|
||
|
|
Онлайн книга - Карнавал молекул | Автор книги - Михаил Левицкий
Cтраница 39

Комплексы антикраунов с некоторыми ароматическими соединениями образуют флуоресцирующие композиции, что открывает перспективы создания на их основе сенсорных (т. е. чувствительных) устройств. По аналогии с обычными краун-эфирами антикрауны, захватывая анион, повышают активность освободившегося катиона, что представляет интерес для катализа. Это удалось подтвердить: экспериментально было показано их каталитическое действие при нитровании ароматических соединений. 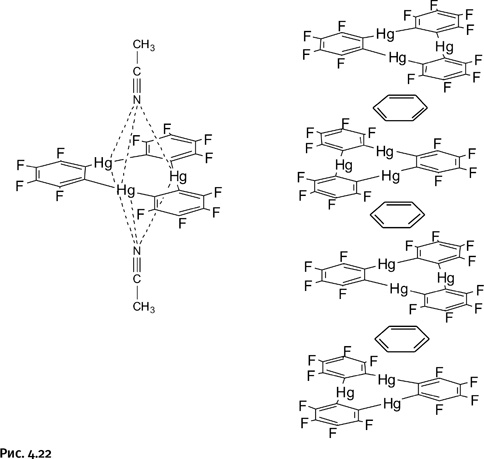
Самая сильная кислота
Потребность необычайного, может быть, самая сильная из потребностей. АЛЕКСАНДР ГРИН В соответствии со старинным определением, которое хорошо работает и в наши дни, кислота – это соединение, которое способно отдавать протон Н+; чем легче это происходит, тем сильнее кислота. Силу обычных неорганических кислот оценивают по тому, насколько полно они распадаются в водном растворе на ионы Н+ и А– (А – анион кислоты). Сразу отметим, что существуют кислоты, не содержащие протонов (льюисовы кислоты, о которых рассказано в главе «Создавать затруднение полезно»), но мы сосредоточим внимание только на протонных кислотах. В 30-х гг. ХХ в. появились так называемые суперкислоты, например фторсульфоновая FS(O)2ОH и трифторметансульфоновая F3CS(O)2ОH (рис. 4.23). 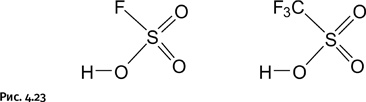
Атомы фтора энергично оттягивают на себя электронную плотность, что заметно облегчает отделение протона Н+ от молекулы кислоты, и он становится значительно более активным. С помощью таких кислот удалось ввести катион (т. е. протон) в органические соединения, например в углеводороды, в результате возникла химия карбкатионов – соединений, содержащих положительный заряд на углеродном атоме С+ (рис. 4.24). 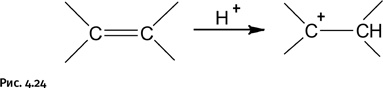
Такие соединения в свою очередь помогли понять механизм многих превращений в органической химии и, кроме того, открыли способы наращивания углеводородной цепи. Для сравнительной оценки силы суперкислот водная среда не подходит, поэтому была выбрана иная шкала, она основана на их способности протонировать органические основания (например, анилин). В качестве точки отсчета взята 100 %-ная серная кислота. По этой шкале трифторметансульфоновая и фторсульфоновая кислоты в тысячу раз сильнее серной кислоты. Недостаток таких кислот состоит в том, что их анионы необычайно реакционноспособны и часто «вмешиваются» в процесс протонирования, приводя к побочным продуктам. Они столь агрессивны, что могут разъедать стекло. Тем не менее силу этих кислот удалось превзойти. В 2006 г. американский ученый К.А. Рид из Калифорнийского университета совместно с российским ученым Е.С. Стояновым из Института катализа Сибирского отделения РАН получили еще более сильную кислоту – она превосходит серную кислоту в миллион раз. Это протонсодержащая кислота, у которой анион представляет собой каркас, собранный из атомов бора и атома углерода (молекула карборана), ко всем атомам бора присоединены атомы хлора с той же целью, с какой были введены атомы фтора в суперкислоты (рядом со структурной формулой на рис. 4.25 показана объемная модель аниона). Авторы скромно назвали полученное соединение карборановой кислотой, хотя могли бы позволить себе яркое рекламное название, например экстрасуперкислота. Отрицательный заряд в ней расположен не у конкретного атома, а равномерно «размазан» по всему каркасу, что заметно снижает реакционную способность аниона, потому он пассивен, кроме того, сам каркас очень устойчив. Эту кислоту, как отмечают авторы, можно хранить в стеклянной таре. С ее помощью удалось протонировать при комнатной температуре органические соединения, такие как изобутен или толуол до соответствующих протонированных производных (рис. 4.26). 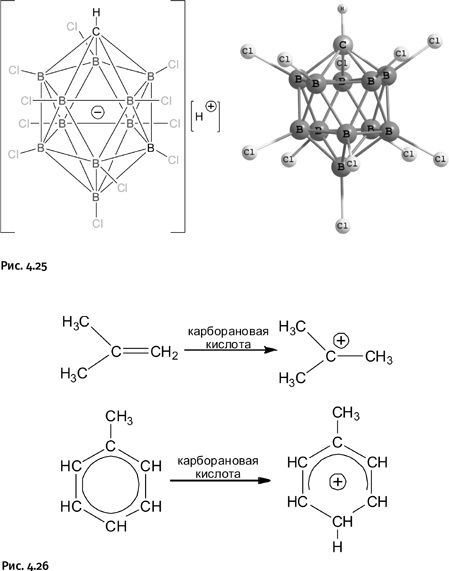
Благодаря тому что карборановый анион инертен и не затрагивает продукты реакции, полученный трет-бутильный катион (верхняя строчка показанной схемы) оказалось возможным выделить и хранить в виде кристаллического вещества, что ранее было недостижимо. Авторы намечают протонировать этой кислотой атомы ксенона, полагая, что им удастся «расшевелить» даже такой необычайно инертный объект. Новая «Царская водка»
Внутри каждого из нас царская душа, каждый хочет, чтобы ему было все позволено, но не хочет быть жертвой чужого произвола. ЛУЦИЙ СЕНЕКА-МЛАДШИЙ Производители спиртных напитков, желая привлечь покупателей, дают различным сортам водки звучные имена; самое яркое, пожалуй, «Царская водка», что предполагает необыкновенные вкусовые качества (рис. 4.27). Такую водку можно увидеть на прилавках магазинов, но химиков от этого названия буквально передергивает, поскольку они знают, что это словосочетание означает нечто совсем неаппетитное – едкая жидкость, растворяющая «царя металлов», т. е. золото. 
Царская водка – не напиток
Царская водка появилась во времена алхимии, она представляет собой смесь трех объемных частей концентрированной соляной кислоты и одной объемной части концентрированной азотной. Такая смесь превращает в хлориды даже золото и платину, которые нерастворимы в каждой из этих кислот в отдельности. Сама царская водка не просто смесь кислот, это продукт их взаимодействия, в результате чего получаются нитрозилхлорид NOCl и хлор (рис. 4.28). 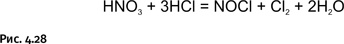
Еще древние алхимики знали, что царская водка должна быть свежеприготовленной. Все дело в том, что при длительном хранении из нее улетучивается хлор и она перестает работать. Два реагента, образовавшиеся в царской водке, взаимодействуют с металлическим золотом Au, переводя его в хлорид AuCl3 (рис. 4.29). 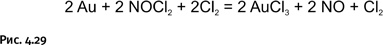
Образовавшийся хлорид золота присоединяет молекулу HCl, образуя комплекс – золотохлористоводородную кислоту H(AuCl4). Обычно такой продукт называют хлорным золотом, он кристаллизуется из водного раствора с четырьмя молекулами воды H(AuCl4)·4Н2О в виде светло-желтых кристаллов.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно