
|
||
|
|
||
|
|
Онлайн книга - Что такое жизнь? | Автор книги - Эрвин Шредингер
Cтраница 14

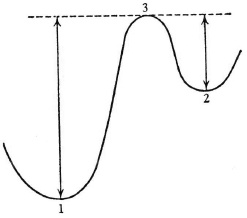
Рис. 12. Энергетический порог (3) между изомерными уровнями (1) и (2). Стрелками показаны минимальные энергии, необходимые для перехода Теперь мы можем внести «вторую поправку», она заключается в том, что переходы подобного «изомерного» рода – единственное, что интересует нас в приложении к биологии. Именно их мы имели в виду, рассматривая «стабильность». Под «квантовым переходом» мы подразумеваем переход из одной относительно стабильной молекулярной конфигурации в другую. Количество энергии, необходимое для перехода (W), есть не реальная разница между уровнями, а шаг с исходного уровня на пороговый (см. стрелки на рис. 12). Переходы без порога между исходным и конечным состоянием нас совершенно не интересуют – и не только в биологическом смысле. Они ничего не привносят в химическую стабильность молекулы. Почему? У них нет длительного эффекта, они остаются незамеченными. Когда они происходят, мгновенно следует возврат в исходное состояние, которому ничто не препятствует. Глава 5
Обсуждение и проверка модели Дельбрюка Действительно, как свет проявляет себя и тьму, так истина служит стандартом самой себя и ошибки. Б. Спиноза. Этика. Ч. II, положение 43 Общий взгляд на наследственный материал Из данных фактов вытекает простой ответ на наш вопрос: могут ли эти структуры, построенные из относительно небольшого числа атомов, длительное время противостоять тепловому движению, которому непрерывно подвергается наследственный материал? Предположим, что ген представляет собой огромную молекулу, способную лишь на дискретные изменения, заключающиеся в перестановке атомов и появлении изомерных молекул. Для удобства я и дальше буду называть этот переход изомерным, хотя нелепо исключать возможность обмена с окружающей средой. Перестановка может затронуть небольшой участок гена, и вероятно множество различных перестановок. Энергетические пороги, отделяющие существующую конфигурацию от любой изомерной, должны быть достаточно высоки в сравнении со средней тепловой энергией атома, чтобы такой обмен являлся редким событием. Подобные редкие события мы назовем спонтанными мутациями. Остаток главы будет посвящен проверке этого общего взгляда на ген и мутацию, которым мы обязаны в основном немецкому физику Дельбрюку, путем подробного сравнения с генетическими фактами. Но прежде сделаем несколько уместных комментариев об основании и общей природе теории. Уникальность взгляда Необходимо ли при рассмотрении биологического вопроса копать столь глубоко и основывать взгляд на квантовой механике? Сейчас предположение о том, что гены являются молекулами, широко распространено. Найдется мало биологов – знакомых с квантовой теорией или нет, – кто не согласится с ним. Ранее мы позволили доквантовому физику озвучить его как единственное разумное объяснение наблюдаемой стабильности. Последующие рассуждения об изомерии, пороговой энергии, важной роли отношения W: kT в определении вероятности изомерного перехода можно было бы представить с чисто эмпирической позиции, уж точно не обращаясь к квантовой теории. Почему же я так настаивал на квантово-механической точке зрения, хотя и не могу доступно объяснить ее в этой книге и рискую утомить читателей? Квантовая механика – первая теоретическая точка зрения, основные принципы которой позволяют учесть все виды скоплений атомов, встречающиеся в природе. Зависимость Гайтлера – Лондона – уникальная, исключительная особенность данной теории, придуманная не для объяснения химической связи. Она возникает сама по себе, весьма интересным и загадочным образом, на основании различных рассуждений. Полностью согласуется с наблюдаемыми химическими фактами, и, как я уже говорил, это уникальная особенность, достаточно понятная, чтобы сказать с определенной уверенностью: в квантовой теории «такого больше не произойдет». Соответственно, мы можем смело утверждать, что у молекулярного объяснения наследственного материала нет альтернативы. Физическая точка зрения не позволяет иным образом объяснить его стабильность. Если взгляд Дельбрюка не подтвердится, то мы будем вынуждены сдаться. Это первое мое заявление. Традиционные заблуждения Однако вы можете спросить: неужели молекулы – единственные стабильные структуры из атомов? А как насчет, например, золотой монеты, две тысячи лет пролежавшей в гробнице и сохранившей отчеканенный на ней портрет? Конечно, монета состоит из множества атомов, но в данном случае мы не склонны объяснять сохранение формы статистикой простых чисел. То же самое касается выросших в скале аккуратных кристаллов, остающихся неизменными на протяжении геологических эпох. Это подводит нас ко второму вопросу, который я хочу прояснить. Случаи молекулы, твердого вещества и кристалла не так уж различаются. В свете современных знаний они почти одинаковы. К сожалению, школьное образование придерживается определенных традиционных взглядов, а они давно устарели и затрудняют понимание действительного положения вещей. Информация о молекулах, которую мы получаем в школе, не дает ни малейшего приставления о том, что они ближе к твердому состоянию, нежели к жидкому или газообразному. Напротив, нас учат различать физические превращения, такие как плавление или испарение, при которых молекулы сохраняются (например, этиловый спирт в твердом, жидком и газообразном состоянии всегда состоит из одних и тех же молекул, C2H6O), и химические, такие как горение спирта: C2H6O + 3O2 = 2CO2 + 3H2O, при котором молекула спирта и три молекулы кислорода претерпевают перестановку и превращаются в две молекулы углекислого газа и три молекулы воды. Про кристаллы нам говорят, что они формируют тройные периодические решетки, в них иногда можно узнать структуру отдельной молекулы, как в случае спирта и большинства органических веществ, в то время как в других кристаллах, например каменной соли (NaCl), нельзя четко выделить молекулы NaCl, поскольку каждый атом Na симметрично окружен шестью атомами Cl, и наоборот, а потому пары молекулярных партнеров обозначаются весьма условно. Наконец, нас учат, что твердое вещество бывает кристаллическим или нет – в последнем случае его называют аморфным. Различные состояния материи Я не стану заявлять, будто все эти утверждения и разграничения ошибочны. Иногда весьма полезны для практических целей. Однако при истинном рассмотрении структуры материи пределы следует обозначать иначе. Фундаментальное различие лежит между двумя строками данной схемы «уравнений»: молекула = твердое вещество = кристалл газ = жидкость = аморфное вещество Вкратце объясним эти утверждения. Так называемые аморфные твердые вещества в действительности не являются ни аморфными, ни твердыми. Рентгеновский анализ выявил рудиментарную структуру кристалла графита в «аморфном» угольном волокне. Итак, уголь представляет собой твердое и одновременно кристаллическое вещество. Если кристаллической структуры не выявлено, то материал следует считать жидкостью с очень высокой «вязкостью» (внутренним трением). Отсутствие четко определенной температуры плавления и скрытой теплоты плавления свидетельствует о том, что такое вещество не является истинно твердым. При нагревании оно постепенно размягчается и в конце концов становится жидким. Помню, в конце Первой мировой войны нам в Вене выдавали похожую на асфальт субстанцию в качестве заменителя кофе. Она была такой твердой, что приходилось использовать стамеску или топорик, чтобы разломать маленький кирпичик на гладкие кусочки. Однако со временем субстанция начинала вести себя как жидкость, уплотняясь в нижней части сосуда, где вы имели неосторожность оставить ее на пару дней.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно