
|
||
|
|
||
|
|
Онлайн книга - Вселенная. Курс выживания среди черных дыр, временных парадоксов, квантовой неопределенности | Автор книги - Дэйв Голдберг , Джефф Бломквист
Cтраница 33

Теперь проведем расчеты для n = 2: l может принимать два значения, 0 и 1. Если l = 1, то m может равняться −1, 0 или +1, то есть получается еще 3 энергетических уровня (всего 4). Для n = 3 l может составлять 0, 1 или 2. Для l = 2 m может равняться −2, −1, 0, +1 или +2, что дает 5 уровней. Итак, всего получается 1 + 3 + 5 = 9 уровней для n = 3. И так далее. Запомните числа для трех первых значений n: 1, 4 и 9. Теперь посмотрим на рис. 7.1, где показаны первые четыре ряда периодической таблицы химических элементов, и подсчитаем, сколько элементов в каждом ряду. Разделив эти значения на 2, мы получим 1, 4, 4 и 9. Важность этого вскоре выяснится. 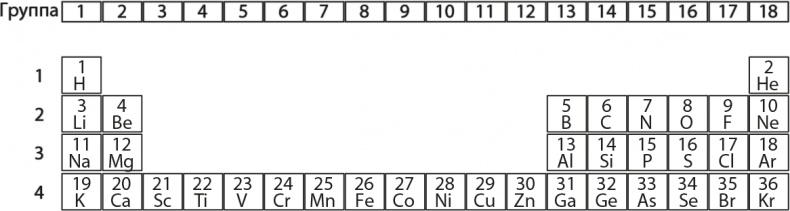
Рис. 7.1. Первые четыре ряда периодической таблицы химических элементов Честь расположения химических элементов подобным образом обычно приписывается русскому химику Дмитрию Менделееву, который представил ее 6 марта 1869 года на заседании Русского химического общества. Это было задолго до того, как придумали вычислять разрешенные энергетические уровни атома водорода. Менделеев расположил элементы в порядке их атомных весов, что на современном языке соответствует количеству протонов и нейтронов внутри атомных ядер, хотя, конечно, в то время он и этого тоже не знал. Расположение элементов на самом деле соответствует числу протонов в ядре (количество нейтронов значения не имеет), но для самых легких элементов эта поправка не имеет значения, благодаря чему Менделеев и сумел расставить их в правильном порядке. Он решил выстроить элементы в ряды и столбцы, отметив, что некоторые элементы обладают очень похожими химическими свойствами, несмотря на разницу атомных весов; вертикальные столбцы как раз и объединяют подобные химические элементы – так, гелий, неон, аргон и криптон в крайнем правом столбце таблицы считаются инертными газами. И Менделеев не только правильно зафиксировал существующее расположение, но и предсказал наличие новых элементов, которые должны были заполнить пробелы в его таблице: элементы 31 и 32 (галлий и германий) были открыты в 1875 и 1886 годах соответственно. Эти открытия подтвердили, что Менделееву удалось нащупать нечто очень важное в строении атомов, но пока никто не знал, что это такое. Удивительно, что в первом ряду 2 элемента, во втором и третьем их 8, а в четвертом – 18. Эти числа ровно в два раза больше тех, что получились у нас после подсчета разрешенных энергетических уровней в водороде. Почему? Как мы уже упоминали, элементы в периодической системе упорядочены слева направо по рядам в соответствии с количеством протонов в ядре, что совпадает с количеством электронов, которое могут содержать эти атомы. Помните, что все атомы электрически нейтральны: положительные электрические заряды протонов точно уравновешиваются отрицательными зарядами электронов. Здесь явно что-то интересное связано с химическими свойствами элементов и разрешенными энергетическими уровнями, который электроны могут иметь во время вращения по орбитам вокруг ядра. Мы можем представить, как более тяжелые атомы строятся из более легких, к которым по очереди добавляются протоны, нейтроны и электроны. Нужно держать в уме, что каждый раз при добавлении лишнего протона в ядро мы должны добавить и дополнительный электрон на один из энергетических уровней. Арифметические упражнения помогут создать систему, которую мы видим в периодической таблице, если просто допустить, что каждый энергетический уровень может содержать два и только два электрона. Посмотрим, как это работает. У водорода только один электрон, который попадает на уровень n = 1. У гелия два электрона, которые тоже разместятся на уровне n = 1. Теперь уровень n = 1 заполнен. Чтобы получить литий, мы должны добавить третий электрон, но он уже пойдет на уровень n = 2. Следующие 7 электронов, соответствующие следующим 7 элементам (бериллий, бор, углерод, азот, кислород, фтор и неон), могут тоже уместиться на уровне n = 2, потому что там имеются 4 места, соответствующие l = 0 и l = 1, m = −1, 0 и +1. Таким образом можно найти место для всех элементов до неона включительно. На неоне уровни n = 2 заполняются, и начиная с натрия мы переходим к n = 3. Следующие 8 электронов один за другим начинают заполнять уровни n = 3; сначала электроны идут на l = 0, затем на l = 1. Это происходит для всех элементов третьего ряда вплоть до аргона. Четвертый ряд таблицы можно объяснить, если предположить, что он содержит все оставшиеся электроны n = 3 (то есть 10 электронов с l = 2) и электроны n = 4 с l = 0 и 1 (всего 8 электронов), так что в итоге и получается волшебное число – 18 электронов. Мы набросали, как электроны заполняют энергетические уровни, для самого тяжелого элемента в нашей таблице – криптона (с его 36 электронами) – на рис. 7.2. 
Рис. 7.2. Заполнение энергетических уровней криптона. Точки символизируют электроны, а горизонтальные линии – энергетические уровни, помеченные квантовыми числами n, l и m. Мы сгруппировали уровни с различными значениями m, но одинаковыми значениями n и l Чтобы изложенное относилось к науке, а не к занимательной математике, предстоит сделать несколько пояснений. Во-первых, нужно объяснить, почему химические свойства элементов из одного и того же вертикального столбца схожи. Из нашей схемы ясно, что первый элемент каждого из трех первых рядов начинает процесс заполнения уровней с увеличивающимся значением n. А именно: водород открывает этот процесс, вводя единственный электрон на пустой до того момента уровень n = 1, с лития начинается второй ряд – первый электрон появляется на пустом до того уровне n = 2, а с натрия третий ряд – электрон занимает пустой до того уровень n = 3. Третий ряд немного выбивается, потому что на уровне n = 3 может находиться 18 электронов, а в самом третьем ряду все же не 18 элементов. Можно предположить, что именно происходит: первые 8 электронов заполняют уровни n = 3 с l = 0 и l = 1, а затем (по каким-то причинам) случается переход на четвертый ряд. Четвертый ряд содержит оставшиеся 10 электронов на уровнях n = 3 с l = 2 и 8 электронов на уровнях n = 4 с l = 0 и l = 1. То, что ряды не совсем соответствуют значению n, свидетельствует лишь о том, что связь между химией и подсчетом энергетических уровней не так проста, как можно было бы подумать. Однако сейчас известно, что калий и кальций, два первых элемента в четвертом ряду, имеют электроны на уровне n = 4, l = 0, а следующие 10 элементов (от скандия до цинка) имеют электроны на запоздалых уровнях n = 3, l = 2.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно