
|
||
|
|
||
|
|
Онлайн книга - Происхождение жизни. От туманности до клетки | Автор книги - Михаил Никитин
Cтраница 53

По этим причинам сейчас серьезно обсуждаются только два варианта расширения (не замены) набора азотистых оснований. Первым таким кандидатом в древние азотистые основания РНК является никотинамид, производное витамина РР, входящий в состав кофермента НАД. Как обсуждалось в главе 10, никотинамид в НАД связан с рибозой и фосфатом как обычное азотистое основание и придает рибозимам новые полезные свойства. В составе генетической молекулы никотинамид может замещать гуанин, образуя пару с цитозином (Liu and Orgel, 1995). Другое возможное дополнение к набору азотистых оснований – группа предшественников аденина и гуанина. Это прежде всего аминоимидазол-карбоксамид-риботид (AICAR), который получается как промежуточный продукт в ходе их синтеза. Эта молекула содержит пятичленное имидазольное кольцо с двумя атомами азота (рис. 12.7) и в составе РНК образует комплементарную пару с аденином (Bernhardt, Sandwick, 2014). AICAR является предшественником не только пуринов, но и важной аминокислоты – гистидина. Чаще всех других аминокислот гистидин встречается в активных центрах ферментов, и AICAR, сходный с ним по строению, мог выполнять аналогичные функции в древних рибозимах. AICAR образуется в небольших количествах при нагревании и облучении формамида, наряду со стандартными азотистыми основаниями. Иначе говоря, расширение набора азотистых оснований имеет смысл для улучшения каталитических свойств РНК, но при этом для хранения наследственной информации стандартный набор А, Г, Ц, У, по-видимому, лучший из всех веществ, которые были доступны на древней Земле. 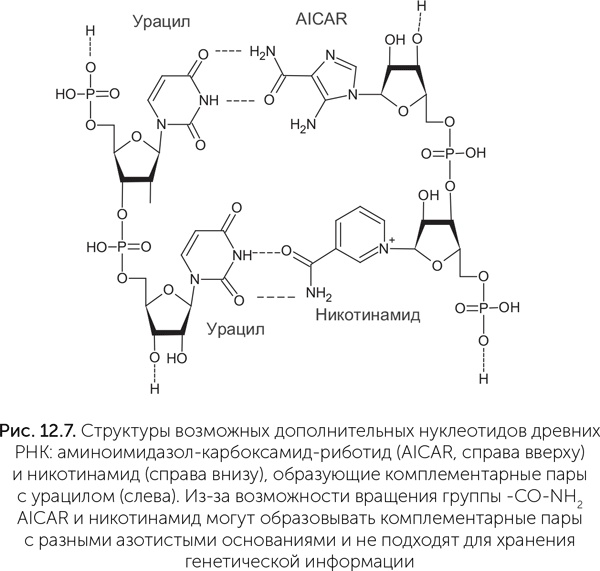
Почему для хранения наследственной информации используются четыре вида азотистых оснований, а не два, шесть или восемь? Как мы помним из главы 6, синтетические азотистые основания позволяют расширить алфавит ДНК до шести букв. Более того, получены синтетические основания, образующие пару только сами с собой, и с ними можно получить алфавит с нечетным числом знаков, например, три или пять. Возможно, дело в устойчивости к ультрафиолету: в природе только четыре основания оснований оказались устойчивыми. Но почему природа не ограничилась двухбуквенным алфавитом? Как обсуждается в обзоре Эёша Шатмари (Szathmary, 2003), двухбуквенный алфавит можно копировать более точно, чем четырехбуквенный. Четыре азотистых основания отличаются двумя параметрами: размером (A и Г большие, Ц и T маленькие) и положением водородных связей. Размер – более важное различие. Замены основания на другое такого же размера (A на Г или Ц на T) в геномах большинства организмов происходят от двух до пяти раз чаще, чем замены с изменением размера. Синтез четырех нуклеотидов требует больше ферментов, чем двух. Для точного копирования ДНК концентрации всех нуклеотидов в клетке должны быть по возможности равными. Поддерживать равные концентрации четырех нуклеотидов сложнее, чем двух. Получается, что для основной современной функции ДНК – хранения информации о последовательности белков – четырехнуклеотидный алфавит подходит хуже, чем двухнуклеотидный. Четырехнуклеотидный алфавит оказывается лучше, чем все прочие, когда дело доходит до образования шпилечной структуры РНК. Математическое моделирование показывает, что РНК-подобная молекула с двумя типами оснований, как правило, имеет множество вариантов сворачивания в различные шпилечные структуры. Для РНК с четырьмя типами оснований обычно есть одна или две устойчивые структуры (Valba et al., 2012). Эксперименты с созданием рибозимов из РНК с ограниченным выбором нуклеотидов (три или даже два из четырех) это подтверждают: при меньшем разнообразии звеньев рибозимы возникают с меньшей вероятностью, и их эффективность ниже, чем у четырехнуклеотидных аналогов (Reader and Joyce, 2002). Треозонуклеиновые и гликоленуклеиновые кислоты
Гораздо больше внимания ученые уделяли поиску альтернатив сахарофосфатному остову РНК, потому что «слабым звеном» РНК является рибоза. Она менее устойчива, чем другие сахара (глюкоза, эритроза, глицеральдегид), и быстрее разлагается. В составе цепочки РНК много неприятностей доставляют гидроксильные (-ОН) группы на втором углеродном атоме каждой рибозы. Они облегчают разрыв цепи РНК. Современная генетическая молекула, ДНК, не имеет этих групп и поэтому, в отличие от РНК, устойчива к щелочам, ионам железа, переносит более высокие температуры, а в нормальных внутриклеточных условиях в десятки тысяч раз менее склонна к самопроизвольным разрывам по сравнению с РНК. Поэтому много исследований было посвящено двум ксенонуклеиновым кислотам, в которых рибоза заменена на четырехуглеродный сахар (треозу) или трехуглеродный спирт (глицерин) – треозонуклеиновая кислота, ТНК, и гликоленуклеиновая кислота, ГНК (рис. 12.8). 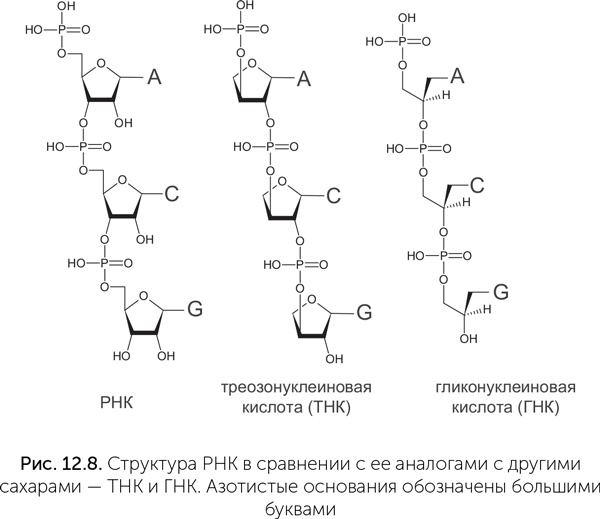
Молекулы треозонуклеиновой кислоты (ТНК) образуют двойные спирали друг с другом и с РНК благодаря комплементарным парам азотистых оснований. Прочность связи двух нитей в таких комплексах примерно такая же, как в двуспиральной ДНК (Schoning et al., 2000). Были получены мутантные формы РНК-полимеразы, которые способны строить ТНК на матрице ДНК, и с их помощью удалось адаптировать для ТНК технологию искусственного отбора (SELEX), применяемую для получения новых рибозимов. Так, из ТНК удалось получить аптамеры – молекулы, которые избирательно связывают одно определенное вещество, в данном случае белок тромбин (Yu et al., 2012). Гликоленуклеиновая кислота (ГНК) была подробно изучена на несколько лет позже, чем ТНК (Zhang et al., 2005). Молекулы ГНК, подобно ТНК, образуют двойную спираль друг с другом и с РНК. Форма нити ГНК такова, что уотсон-криковские пары в ней оказываются прочнее, чем в РНК, поэтому копирование ГНК на заре жизни могло быть более точным, чем РНК. С другой стороны, эта же особенность ГНК требует более высокой температуры, чтобы расплести ее двойные спирали для следующего цикла копирования. ТНК и ГНК, подобно ДНК, не имеют свободных гидроксильных (-ОН) групп рядом с фосфоэфирной связью и поэтому устойчивы к щелочам, железу и высокой температуре. Однако эти 2' – гидроксильные группы, которые делают РНК уязвимой, одновременно важны для ее каталитических функций. Попытки получить дезоксирибозимы из ДНК показали, что они встречаются в смеси молекул случайной последовательности с вероятностью в 10–100 раз меньше, чем аналогичные по функциям рибозимы из РНК (Silverman, 2004). Скорее всего, ТНК и ГНК по каталитической активности уступают РНК и близки к ДНК. Еще один аргумент против роли ТНК и ГНК в происхождении жизни связан с проблемой соединения азотистых оснований с сахарами. Как обсуждалось в главе 7, азотистые основания невозможно правильно соединить с рибозой или другим сахаром без помощи ферментов. Все недавно открытые обходные пути получения нуклеотидов, в которых эта проблемная связь образуется до завершения сборки азотистого основания, строго привязаны к химическим свойствам рибозы и непригодны для получения нуклеотидов ТНК и ГНК. Наконец, факт существования ДНК, которая по надежности хранения информации не лучше ТНК, но заметно сложнее в синтезе и явно произошла в процессе эволюции от РНК уже после появления белков (подробнее см. в главе 14), тоже говорит против древней жизни с ТНК или ГНК. Если эти ксенонуклеиновые кислоты когда-либо использовались жизнью, то сложно придумать причину, по которой столь простые и надежные генетические молекулы были бы потеряны и затем заменены более сложной ДНК, – жизнь редко полностью отказывается от проверенных решений.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно