
|
||
|
|
||
|
|
Онлайн книга - Происхождение жизни. От туманности до клетки | Автор книги - Михаил Никитин
Cтраница 51

Кремний из-за большего размера атома практически не способен участвовать в двойных связях. В оксиде углерода CO2 углерод связан двойными связями с двумя атомами кислорода, и при обычных условиях СО2 – газ. В оксиде кремния SiO2 каждый атом Si связан одинарными связями с четырьмя атомами кислорода, каждый из которых образует мостик между двумя атомами кремния. Поэтому SiO2 образует твердые тугоплавкие кристаллы, например кварц. Многие соединения кремния более химически активны, чем их аналоги с углеродом. Если метан (СН4) не реагирует с водой ни в обычных условиях, ни при сильном нагревании, то силан (SiH4) при комнатной температуре быстро разлагается водой с выделением водорода и кремниевой кислоты: SiH4 + 3H2O → 2H2 + H2SiO3. В подобные реакции вступают и многие другие соединения кремния, где атомы кремния не связаны с кислородом или азотом. Химик сказал бы примерно следующее: «Кремний – элемент третьего периода, поэтому его атом имеет незаполненные 3d-орбитали, которые позволяют ему проявлять электрофильные свойства и легче вступать в реакции с нуклеофилами». Так что кремний, с одной стороны, образует очень прочные и устойчивые связи с кислородом, которые, в отличие от связей С-С, практически невозможно ослабить, а с другой – большинство других его химических связей неустойчивы в присутствии воды, аммиака и кислот. Поэтому практически в любых известных в космосе условиях кремний находится в виде устойчивых кристаллов оксида кремния и силикатов, иногда – карбидов и нитридов кремния, но не образует тех сложных молекул, которые получены в лаборатории. Углерод же не только на планетах, но и в межзвездных газово-пылевых облаках легко образует разнообразные органические соединения. Известны и другие элементы, которые образуют сложные и разнообразные молекулы. Например, сосед углерода слева в периодической системе – бор. Его атом имеет три валентных (образующих химические связи) электрона, поэтому с кислородом образует три связи (например, в борной кислоте H3BO3). При этом атом бора не может достроить свою внешнюю электронную оболочку до восьми и образует уникальные дополнительные связи, охватывающие сразу три атома (рис. 12.4, справа). 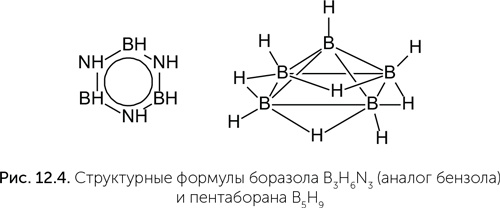
В паре с азотом он может образовать близкие аналоги органических соединений углерода: например, боразол – неорганический аналог бензола. К сожалению, большинство соединений бора химически очень активны и легко реагируют с водой, образуя борную кислоту. Но это не главный недостаток бора. Гораздо хуже то, что во Вселенной его крайне мало, примерно в 1 млн раз меньше, чем углерода. Ядра атомов бора менее устойчивы, чем ядра углерода и гелия, и в звездах бор быстро превращается в гелий и углерод. Те скромные количества бора, которые все же есть, образовались в результате ядерных реакций в газово-пылевых облаках под действием космических лучей. Таким образом, существование жизни на основе бора запрещено ядерной физикой. Очень экзотические сложные молекулы могут быть возможны на основе азота при сверхвысоких давлениях. Как предсказано в работах Артема Оганова (профессор Нью-Йоркского университета в Стоуни-Брук и Сколковского института науки и технологий), при давлениях выше 360 000 атмосфер азот может образовывать устойчивые разнообразные цепочки, кольца и плоские слои. Разнообразие азотоводородных молекул в этих условиях не уступает разнообразию углеводородов при обычном давлении (рис. 12.5). К сожалению, это разнообразие известно только по квантово-механическому моделированию поведения атомов и молекул. Проверить эти расчеты экспериментально очень трудно, потому что такие уровни давления достижимы лишь в очень малых объемах на гидравлических прессах с алмазными столами. В природе подобные условия могут существовать в глубинах водно-аммиачно-метановых океанов Урана и Нептуна. 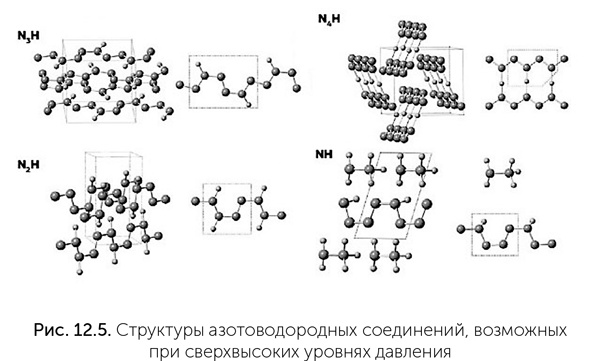
Много шума вызвала публикация, сообщавшая о бактерии, которая заменила часть фосфора в своих клетках на мышьяк (Wolfe-Simon et al., 2010). Однако более тщательные исследования опровергли этот результат. Как оказалось, это просто бактерия, устойчивая к мышьяку, в том числе и внутри клетки. В состав ее ДНК и других веществ входит фосфор, а не мышьяк, как и у всех других земных организмов. Альтернативная биохимия на тех же элементах
Как мы видим, реальной альтернативы углероду, кислороду и азоту не существует. Но, может быть, на основе этих же элементов возможна другая биохимия, непохожая на земную? Такое исключить нельзя. Возможны, например, другие растворители, кроме воды, и в них неизбежно будет совсем другая биохимия. Единственное действительно уникальное свойство воды – меньшая плотность льда по сравнению с жидкой водой. Благодаря этому водоемы зимой замерзают с поверхности, и потом слой льда замедляет потерю тепла и предотвращает полное промерзание. В озерах из других жидкостей при охлаждении твердое вещество будет тонуть, и полное промерзание наступит быстро. С точки зрения обитателей озера эта особенность воды очень полезна. Но для биосферы в целом, наоборот, такое поведение воды вредно. Лед на поверхности озер и морей отражает солнечный свет гораздо лучше, чем вода, что приводит к дополнительному остыванию планеты. Поэтому наступление ледников – самоподдерживающийся процесс. Если бы вместо воды наши моря состояли из любой другой жидкости, то климат планеты Земля был бы устойчивее. Очевидный кандидат на замену воды – жидкий аммиак. Его молекулы тоже полярны и образуют много водородных связей, он остается жидким в широком диапазоне температур (от –78 до –33 °C при обычном давлении) и хорошо растворяет разные полярные вещества. В аммиачном растворе биохимия неизбежно будет другой, так как карбонильные (С=О) группы, очень важные для нашей земной биохимии, в аммиаке быстро превращаются в иминогруппы (C=NH). В среде аммиака иминогруппы обеспечивают такие же перестройки углеродных скелетов, как C=O в воде. Аммиак по сравнению с водой имеет тот недостаток, что в нем гораздо лучше растворяются неполярные молекулы. Поэтому липидные мембраны, ограничивающие наши клетки в водной среде, в аммиаке будут работать плохо. Если мы посмотрим на нашу Солнечную систему, то увидим, что, в отличие от воды, аммиак в чистом виде в ней не встречается. Везде, где есть много аммиака, он смешан с водой и часто еще с метаном, будь то бездонные океаны Урана и Нептуна, ледяные кометы, спутники дальних планет и объекты пояса Койпера. На Титане водяной лед содержит 10–15 % аммиака. Под ледяной корой Титана находится глубокий водно-аммиачный океан. Водно-аммиачная смесь по нескольким признакам лучше подходит для биохимии, чем чистый аммиак. По сравнению с ним она замерзает при еще более низких температурах (до –96 °C) и не растворяет углеводороды, поэтому в ней возможно существование липидных мембран, как и в воде. В водно-аммиачной смеси реакции обмена веществ могут происходить с помощью как С=О групп, так и C=NH, что допускает бóльшую гибкость, чем наша земная биохимия.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно