
|
||
|
|
||
|
|
Онлайн книга - Происхождение жизни. От туманности до клетки | Автор книги - Михаил Никитин
Cтраница 52

Еще один возможный растворитель – серная кислота. Она замерзает при +10 °C и кипит при +290 °C, прекрасно растворяет разные вещества и встречается в космосе в чистом виде, например в облаках Венеры. На поверхности планет, потерявших воду аналогично Венере, но более прохладных, возможно существование жидкой серной кислоты. В серной кислоте достаточно легко идут разные химические реакции, и роль карбонильной группы С=О в ней может играть просто двойная связь между атомами углерода: С=СН2 (рис. 12.6). 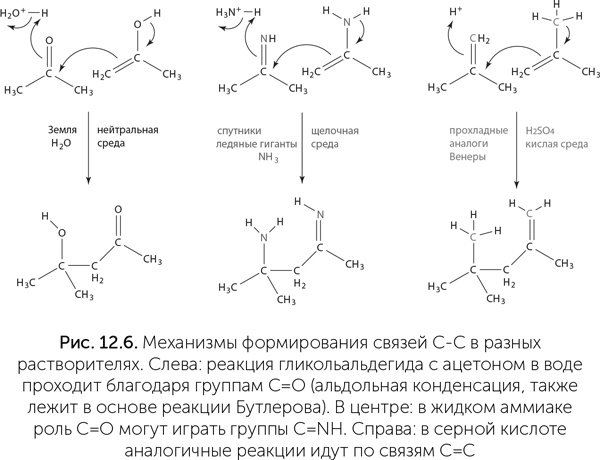
Хотя мы не можем предсказать, какие молекулы будут использоваться живыми существами в аммиаке или серной кислоте, понятно, что наши азотистые основания не подойдут для генетических полимеров в такой среде. Уотсон-криковские пары образуются только в нейтральной среде (pH от 6 до 9). В кислой среде к аминогруппам (NH2) аденина и цитозина присоединяются протоны, дающие положительный заряд, а в щелочной среде, наоборот, гуанин и урацил теряют протоны и получают отрицательный заряд на месте карбонильной группы (С=О). И то и другое нарушает водородные связи между основаниями и делает эти основания непригодными для хранения генетической информации. Поэтому все микробы, населяющие сильнокислые или щелочные среды на Земле, поддерживают внутри клетки нейтральный pH, даже если на это уходит много энергии. Еще воду можно заменить жидкой углекислотой. При обычном давлении она не существует (сухой лед сразу переходит в газ, минуя жидкую стадию), но при повышении давления становится жидкостью. При давлении 70 атмосфер СО2 остается жидким в диапазоне температур от –50 до +31 °C, а при более высоких температурах и уровнях давления переходит в сверхкритическое состояние. Сверхкритическое состояние вещества наступает при температуре и давлении выше критической точки (для СO2 это 31 °C и 74 атмосферы, для воды – 374 °C и 218 атмосфер), оно сочетает плотность жидкости и подвижность газа и растворяет разные вещества гораздо активнее, чем обычная жидкость. Жидкая углекислота растворяет многие вещества не хуже воды. Более того, она во многом совместима с существующей биохимией. Например, липазы и ряд других ферментов в сверхкритическом СО2 работают даже активнее, чем в водной среде, и в биотехнологии это свойство уже нашло применение. Хотя сверхкритический СО2 используется для мягкой стерилизации пищевых продуктов, его антибактериальное действие связано только с растворением клеточных мембран. Ни белки, ни нуклеиновые кислоты в СО2 не страдают. Известны штаммы плесени и бактерий (например, Pseudomonas putida), которые благодаря особому составу липидов устойчивы к некоторым органическим растворителям. Они сохраняют жизнеспособность и в сверхкритическом СО2 (Budisa и Schulze-Makuch, 2014). Как оказалось, существуют природные микробные сообщества, приспособленные к жизни в жидкой углекислоте. На дне Окинавского желоба (Восточно-Китайское море) были найдены гидротермальные поля, на которых из недр на поверхность дна выходит жидкий СО2. Японские океанологи, исследуя этот район, обнаружили на поле Йонагуни Кнолл IV на глубине 1380 м целое озеро жидкого СО2, скрытого в толще осадков на морском дне (Inagaki et al., 2006). Диаметр озера достигает 200 м, толщина слоя жидкого СО2 – около 30 см, температура – от +3 до +10 °C. В пропитанных СО2 неконсолидированных глинистых осадках над озером обитает разнообразное микробное сообщество с численностью до 1 млрд клеток на 1 см³, которое питается, окисляя идущий снизу метан и сероводород. В толще углекислотного озера есть те же самые микробы, но их численность меньше. Так что среда жидкого СО2 вполне совместима с жизнью, и она может иметь много общего с привычной нам жизнью в водной среде. Если на Земле жидкий СО2 встречается в отдельных местах на глубине, то на более массивной планете («суперземля»), получающей меньше солнечного тепла, возможны океаны жидкого СО2 с небольшой примесью воды на поверхности. Жизнь на такой планете может использовать белки и нуклеиновые кислоты, похожие на земные, но иметь совершенно другие материалы клеточных мембран. Еще один возможный альтернативный растворитель – формамид (NH2CHO). Этот органический растворитель достаточно безопасен для живых клеток. Он даже используется в смесях для криоконсервации тканей и клеток, так как защищает их мембраны от разрыва ледяными кристаллами. Формамид легко образуется при взаимодействии синильной кислоты с водой. Он остается жидким при температурах от +3 до +220 °C, и по удельной теплоте испарения сравним с водой. Формамид растворяет большинство веществ, растворимых в воде. Как мы помним по предыдущим главам, очень вероятно, что наша земная жизнь делала самые первые шаги не в воде, а в водно-формамидных растворах. Можно себе представить планету, на которой формамид образует не только маленькие лужицы, но и озера, и моря. Жизнь в такой среде может иметь те же азотистые основания, что и у нас, но, скорее всего, другой набор аминокислот и другие клеточные мембраны. Альтернативные варианты биохимии на древней Земле. Ксенонуклеиновые кислоты
Мир РНК, который мы рассматривали в предыдущих главах, тоже является альтернативным вариантом биохимии по сравнению с современной земной жизнью. В самом деле, мир РНК не использует белки, которые стали важнейшей и неотъемлемой частью современной биохимии. Однако РНК не очень устойчива, а ее получение полностью абиогенным путем (без участия каких-то ферментов белковой, РНК или другой природы) очень сложно и наталкивается на много препятствий, часть которых была преодолена совсем недавно, а другие остаются актуальными до сих пор. Многие ученые пошли дальше и предположили, что миру РНК тоже предшествовала какая-то другая, более простая жизнь, использующая другие молекулы. Эти предшественники РНК должны были легче получаться абиогенно и обладать большей устойчивостью по сравнению с РНК. Чтобы хранить генетическую информацию и со временем уступить место РНК, эти молекулы должны были содержать те же азотистые основания, что и РНК, или хотя бы совместимые с ними по комплементарным парам, а остов этих молекул должен допускать их соединение с РНК в двойную спираль, состоящую из двух химически различных цепей (такая конструкция называется «гетеродуплекс»). Молекулы, удовлетворяющие этим требованиям, получили название «ксенонуклеиновые кислоты». В разделе «Пребиотическая химия альтернативных нуклеиновых кислот» (Cleaves II and Bada, 2012) сборника «Бытие – что было в начале» (Genesis – In the Beginning) собрана информация о свойствах различных ксенонуклеиновых кислот и об их возможных образованиях на древней Земле. Идеи о замене азотистых оснований, хотя и высказывались, но не получили широкого распространения. Во-первых, стандартные азотистые основания легко и с высоким выходом получаются абиогенно (из синильной кислоты или из формамида) и достаточно устойчивы для накопления. Во-вторых, альтернативные азотистые основания, как правило, несовместимы со стандартными, а для тех, что совместимы, сложно найти какие-то преимущества по сравнению с обычным набором. В-третьих, высокая устойчивость к ультрафиолету (см. главу 6) уникальна для стандартных оснований и не встречается ни у каких их аналогов.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно