
|
||
|
|
||
|
|
Онлайн книга - Происхождение жизни. От туманности до клетки | Автор книги - Михаил Никитин
Cтраница 35

Помимо бета-распада слабое взаимодействие существует между электронами и ядрами всех атомов и молекул в каждый момент времени. Энергия слабого взаимодействия входит в энергию покоя молекулы и отличается у двух оптических изомеров. Для свободных аминокислот эта разница ничтожно мала (менее 10–11 кДж/моль) и никак не может влиять на химические реакции, характерные изменения энергии в которых в тысячу миллиардов раз больше. Однако эта разница сильно зависит от массы центрального атома хиральной молекулы – пропорционально шестой степени! Поэтому в комплексах аминокислот с тяжелыми металлами разница энергии покоя, вносимая слабым взаимодействием, теоретически может быть достаточно большой, чтобы проявляться в химических реакциях. Кроме того, вклад энергии слабого взаимодействия может быть гораздо заметнее не в обычных химических реакциях, а в более низкоэнергетических процессах – образовании кристаллов из раствора и образовании комплексных соединений, или при температуре вблизи абсолютного ноля, когда энергия теплового движения молекул минимальна. Так или иначе, эту разницу удалось экспериментально наблюдать в процессах кристаллизации этилендиаминовых комплексов кобальта и иридия. При медленном упаривании раствора левые изомеры этих комплексов выпадали в осадок быстрее, разница составила 0,02 % для комплекса с кобальтом и 1,2 % для комплекса с иридием (Szabó-Nagy et al., 1999). Известен один случай, когда левые и правые аминокислоты ведут себя по-разному в химической реакции с веществом, не имеющим левых и правых изомеров. Это солевой синтез пептидов, который мы упоминали в главе 6: в крепком растворе NaCl или KCl с ионами меди в качестве катализатора аминокислоты самопроизвольно соединяются в короткие пептиды. Избыток соли сдвигает равновесие в сторону синтеза, несмотря на водную среду. Хотя расчетная разница в уровнях энергии между левым и правым изомерами аминокислоты в комплексе с медью недостаточна для заметного влияния на химические реакции, в эксперименте для трех аминокислот – аланина, валина, изолейцина – соединение двух молекул левых изомеров происходит на 10–50 % быстрее, чем двух правых. Для других аминокислот такой заметной разницы нет, и непонятно, почему теория не сходится с опытом только для этих трех аминокислот. Химическое усиление превращает небольшую хиральную асимметрию в хиральную чистоту
Так или иначе, чтобы небольшой избыток одного оптического изомера, порожденный астрономическими или квантовыми процессами, превратился в хиральную чистоту аминокислот и нуклеотидов живой материи, необходимы еще два шага. Во-первых, небольшой избыток должен быть усилен; и, во-вторых, хиральная асимметрия должна быть передана от аминокислот к рибозе и нуклеотидам, причем так, чтобы левым аминокислотам соответствовала правая рибоза. Самый простой механизм усиления избытка одного изомера можно вывести из опытов Пастера с винной кислотой. Как мы помним, изомеры винной кислоты кристаллизуются по отдельности, и образуется смесь «левых» и «правых» кристаллов, так называемый конгломерат. Если же упаривать раствор с «метеоритным» соотношением изомеров 60:40, то преобладающий изомер начнет выпадать в осадок раньше. Вовремя остановив упаривание, можно получить чистые кристаллы одного изомера и равную их смесь в растворе. Большинство аминокислот ведут себя противоположным образом: при упаривании раствора сначала выпадают рацемические кристаллы (с отношением изомеров точно 1:1), и раствор обогащается тем изомером, которого было больше в исходной смеси. Так, из раствора фенилаланина с отношением изомеров 52:48 удалось в два цикла упаривания получить раствор с долей L-изомера 90 % (Breslow, Levine, 2006). Аналогично ведет себя и главный оптически активный промежуточный продукт (и автокатализатор) реакции Бутлерова – глицеральдегид. Его чистые изомеры при комнатной температуре вообще не кристаллизуются, а образуют сироп, который смешивается с водой в любых пропорциях. Смесь изомеров легко образует кристаллы с температурой плавления 145 °C. Поэтому при упаривании растворов глицеральдегида с небольшим избытком одного изомера можно получить этот изомер с чистотой до 99,9 % (Breslow, 2011). Рибоза, глюкоза и другие пяти– и шестиуглеродные сахара неспособны к такой самоконцентрации оптически активного изомера, но рибоза в составе нуклеозидов (напомню, это сахар плюс азотистое основание; если присоединить к нуклеозиду остаток фосфорной кислоты, получится нуклеотид) способна. Нуклеозиды, подобно аминокислотам, предпочтительно выпадают в осадок в соотношении изомеров 1:1, оставляя в растворе избыточный изомер. Таким образом, они могут накапливаться в растворе в оптически чистой форме (Breslow, Cheng, 2010). Еще один механизм разделения изомеров аминокислот связан с адсорбцией на кристаллах минералов (Hazen et al., 2001). Некоторые типы кристаллических структур имеют отдельные хиральные грани. Кристалл в целом при этом не хирален, так как зеркальное отражение хиральной грани есть на другой стороне того же кристалла. Самый обычный минерал с такой структурой – кальцит, основная разновидность карбоната кальция. При оседании аминокислот на кристаллы одни грани обогащаются L-изомером, а другие – D-изомером (рис. 8.3). При соединении аминокислот на поверхности такого кристалла будут образовываться пептиды высокой хиральной чистоты даже из раствора с равным содержанием левых и правых аминокислот. 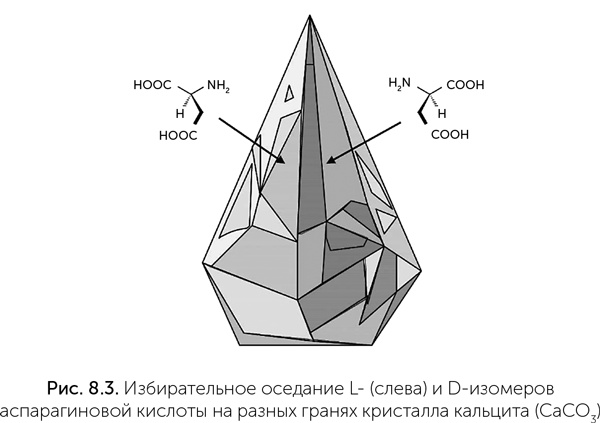
В некоторых условиях можно получить хирально чистые аминокислоты из смеси равных количеств обоих изомеров. Группа испанских химиков под руководством Кристобаля Вьедма (Viedma, 2008) показала, что, если нагреть раствор аспарагиновой кислоты с добавлением салицилового альдегида и уксусной кислоты до 100–130 °С, образуются чистые кристаллы одного оптического изомера. Повторяя опыт много раз, ученые с равной вероятностью получали как правый, так и левый изомер. А добавляя небольшой начальный избыток одного изомера, они всегда в конце опыта получали его в чистом виде. Аспарагиновая кислота – это одна из двух аминокислот, оптические изомеры которых кристаллизуются раздельно. Салициловый альдегид в кислой среде позволяет растворенным изомерам переходить друг в друга, поэтому небольшие случайные отклонения в начале кристаллизации постепенно приводят к полному превращению смеси в чистый L– либо D-изомер (рис. 8.4). 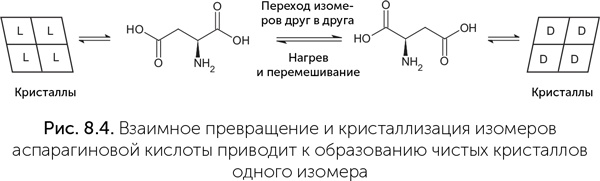
Распознавание изомеров друг другом может происходить не только при образовании кристаллов. В 1996 году коллективом японских химиков была открыта реакция, названная по имени руководителя группы – реакция Соаи (Blackmond, 2010). В ней из двух оптически неактивных веществ (пиримидиновый альдегид и цинкоорганическое соединение) образуется оптически активный пиримидиновый спирт, причем соотношение изомеров далеко от 1:1 и случайно меняется от опыта к опыту (рис. 8.5). Загадочные свойства этой реакции десять лет не удавалось объяснить, но теперь мы знаем, что тут действует три фактора:
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно