
|
||
|
|
||
|
|
Онлайн книга - Происхождение жизни. От туманности до клетки | Автор книги - Михаил Никитин
Cтраница 32

Чтобы решить эту проблему, ученые пошли другим путем. Если не удается правильно соединить готовые азотистые основания с рибозой, то можно попробовать создавать эту связь до того, как рибоза и азотистые основания будут достроены. Есть три возможных пути: строить азотистые основания на готовой рибозе, строить рибозу на готовом азотистом основании и строить и то и другое одновременно. Первый путь, кстати, используется в клетках для синтеза адениновых и гуаниновых нуклеотидов из простых предшественников. В экспериментах были достигнуты успехи на всех трех направлениях. Так, если взять сухую смесь тех веществ, из которых в клетках образуется аденин (это три аминокислоты: глицин, глутамин, аспарагиновая кислота, а также соли муравьиной и фосфорной кислот и рибоза), и запекать ее при температуре 120–150 °C без доступа воздуха, то образуется нуклеотид аденозин-монофосфат с выходом 2–3 % и нуклеозид (азотистое основание с рибозой без фосфора) с выходом до 5 % (Kritsky et al., 2007). В водном растворе рибозо-3-фосфата при добавлении цианамида и цианоацетилена получается нуклеотид цитидин-монофосфат (рис. 7.4) (Ingar et al., 2003). В обоих этих случаях предшественники азотистого основания сначала реагируют с рибозой, а потом этот промежуточный продукт становится нуклеотидом. 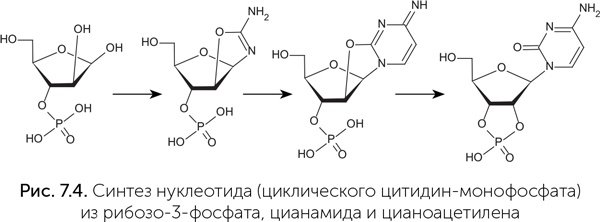
Второй путь начинается с побочных продуктов синтеза азотистых оснований из формамида. Наряду с аденином, гуанином, цитозином и урацилом при этом получаются их формильные производные, имеющие альдегидную (CHO) группу на одном из атомов азота в кольце, чаще всего именно на том, который образует связь с сахаром в нуклеотидах. Эта группа может служить затравкой для построения сахара, если такое вещество (например, 9-формил-аденин) попадет в условия реакции Бутлерова – щелочную среду с формальдегидом. Все хитрости, которые позволяют получить в реакции Бутлерова именно рибозу, а не пригоревшую карамель, здесь тоже работают. Наконец, возможность получения нуклеотидов по третьему пути, когда ни рибоза, ни азотистые основания не встречаются на промежуточных стадиях, была показана в 2009 году в работе Сазерленда с коллегами из Школы химии Манчестерского университета (см.: Клещенко Е. Реакция начала жизни // Химия и жизнь. 2009. № 7). Они получили активированные пиримидиновые нуклеотиды (циклические 2',3'урацил– и цитидинмонофосфаты), смешивая в одной системе сразу и предшественники сахаров, и предшественники нуклеотидов, и фосфат. Казалось бы, это крайне расширяет круг возможных химических реакций, а значит, побочных продуктов должно быть больше. Но эксперимент опроверг это предположение. 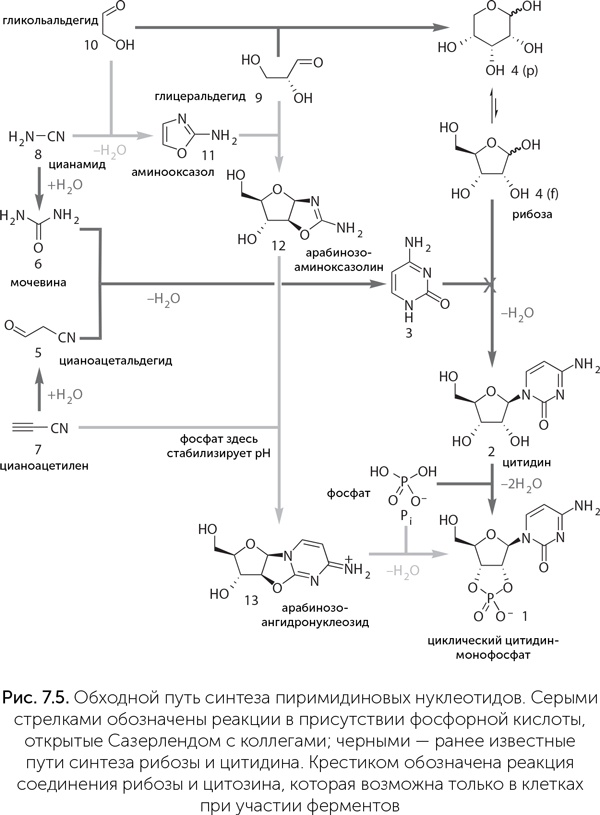
Авторы использовали цианоацетилен (на рис. 7.5 это № 7), цианамид (№ 8), глицеральдегид (№ 9) и гликольальдегид (№ 10). Фосфат облегчает реакции, приводящие в итоге к нуклеотидам, и подавляет другие, побочные. Так, он направляет реакцию цианамида с гликольальдегидом в сторону промежуточного продукта № 11 (2-аминооксазол), а затем реакцию его с глицеральдегидом с образованием продукта № 12 (арабинозо-аминооксазолин). Затем продукт № 12 реагирует с цианоацетиленом, давая вещество № 13 (арабинозо-ангидронуклеозид). В обычном водном растворе при этом повышается pH, и среда становится щелочной, что приводит к распаду промежуточных продуктов и побочным реакциям с цианоацетиленом, но фосфат и тут приходит на помощь, поддерживая среду кислой и направляя реакцию в сторону продукта № 13. Для его превращения в циклический цитидин-монофосфат достаточно подогреть реакционную смесь – все необходимое в ней уже имеется. Катализатором фосфорилирования становится мочевина, образующаяся из цианамида в ходе одной из побочных реакций. Наконец, чтобы избавиться от побочных продуктов этой реакции и превратить часть цитозина в урацил, достаточно осветить раствор ультрафиолетом. Этот синтез поражает своим изяществом: побочные продукты одних реакций здесь становятся катализаторами последующих, фосфат направляет реакции в нужную сторону задолго до того, как войти в окончательный продукт, а ключевой промежуточный продукт (№ 11) способен к самоочищению и накоплению в высоких концентрациях благодаря своей высокой летучести – он хорошо испаряется из водных растворов при слегка повышенной температуре и конденсируется во время ночных заморозков. Как написал редактор журнала Nature в предисловии к работе команды Сазерленда, «именно потому, что эта работа открывает так много новых направлений исследований, она на многие годы останется одним из великих достижений пребиотической химии». Вскоре в той же лаборатории аналогичным способом были получены и пуриновые нуклеотиды (циклические аденозин– и гуанозин-монофосфаты). Для этого оказалось достаточно добавить в систему синильную кислоту вместо цианоацетилена (рис. 7.6) (Powner et al., 2010). 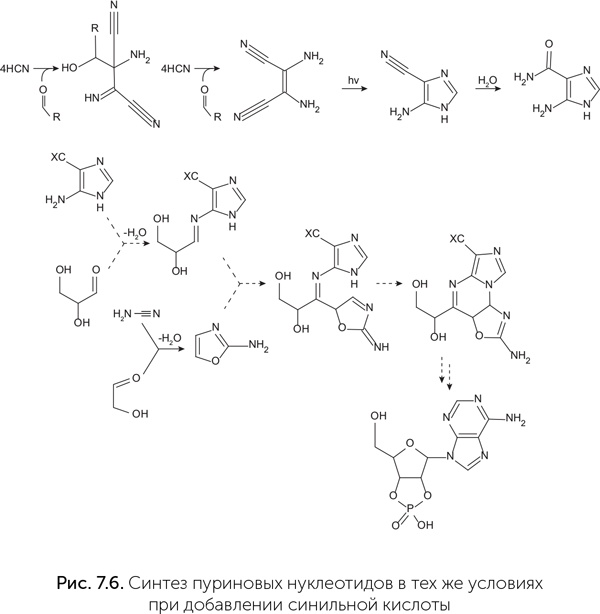
Цианосульфидный протометаболизм
При всей важности результатов лаборатории Сазерленда и в этих путях синтеза есть к чему придраться. Во-первых, для них требуется последовательное добавление разных исходных веществ: сначала смешать гликольальдегид и цианамид, потом добавить глицеральдегид, а затем – цианоацетилен. Если смешать все сразу, то нуклеотиды практически не получаются. Во-вторых, не очень понятно, откуда взять простейшие сахара (гликольальдегид и глицеральдегид). В реакции Бутлерова они образуются из формальдегида, но тут же превращаются в более сложные сахара. Способов остановки реакции Бутлерова на глицеральдегиде пока неизвестно. В-третьих, для получения нуклеотидов нужны в больших количествах цианамид и цианоацетилен, а в атмосферных процессах они образуются в гораздо меньшем количестве, чем цианид. Сотрудники Сазерленда обратили внимание на другие пути получения сахаров. В химии давно известен синтез Килиани – Фишера, в котором цианид реагирует с формальдегидом, давая гликольнитрил (рис. 7.7). На второй стадии гликольнитрил восстанавливается, а на третьей реагирует с водой, выделяя аммиак, и превращается в гликольальдегид. Аналогично гликольальдегид может присоединить следующую молекулу цианида и превратиться в глицеральдегид и далее в более сложные сахара. Первая и третья реакции этого синтеза легко происходят в водном растворе без дополнительных условий, а вот на втором шаге нужны водород и определенный катализатор: палладий на сульфате бария (Pd/BaSO4). Просто палладий и другие металлы, катализирующие восстановление водородом (платина, никель), не подходят, так как вызывают побочные реакции восстановления, приводящие к образованию этиленгликоля и этаноламина. Понятно, что на древней Земле не было палладия на сульфате бария, поэтому синтез Килиани – Фишера долго не привлекал внимания специалистов по предбиологической химии. Однако недавно удалось найти подходящий восстановитель, который наверняка был на древней Земле: это сероводород (Ritson and Sutherland, 2013). В качестве катализатора при этом используются цианидные комплексы меди. Под действием ультрафиолета эти комплексы отнимают электроны от сероводорода (который превращается в серу) и передают их другим молекулам, в том числе гликольнитрилу. Механизм реакции получается сложнее, чем обычный синтез Килиани – Фишера, и кроме сахаров (гликольальдегида и глицеральдегида) получаются побочные продукты, прежде всего аминокислоты: глицин, аланин, серин и треонин.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно