
|
||
|
|
||
|
|
Онлайн книга - Занимательная квантовая физика | Автор книги - Матвей Бронштейн
Cтраница 11

Небольшую путаницу, которая еще оставалась у Берцелиуса, устранил в 1860 году итальянский химик Станислав Канниццаро; собравшийся 3 сентября 1860 года в Карлсруэ Международный конгресс химиков принял систему относительных атомных масс, предложенную Канниццаро, и этот момент принято считать началом современной химии. Мы приведем таблицу химических элементов и их атомных масс, принятую в настоящее время. Заметим только, что теперь в качестве единицы атомной массы уже больше не принимают массу атома водорода, как предлагал в свое время Дальтон. Сейчас атомная единица массы (а.е.м.) выбрана так, чтобы масса атома самого распространенного изотопа углерода была в точности равна 12 а.е.м. Масса атома водорода оказалась при этом чуть больше 1 а.е.м. В таблицах обычно указывают относительную атомную массу химического элемента — отношение массы атома элемента к атомной единице массы. Эта система единиц принята и в той таблице, которую мы приводим. Что касается указанных там же значков (символов) химических элементов, то они уже нисколько не похожи на кружки Дальтона. Берцелиус предложил — и это было принято огромным большинством химиков, а потом и всеми без исключения — применять в качестве значка химического элемента начальную букву или две буквы его латинского названия (например, водород обозначать буквой Н от латинского Hydrogenium, азот — буквой N от латинского Nitrogenium, железо — значком Fe от Ferrum, медь — Cu — от Cuprum, углерод — С от Carbo и т. д.). Когда нужно обозначить молекулу, то, если в ней есть несколько атомов одного и того же химического элемента, обозначение этого атома не повторяется, как это делал Дальтон, изображавший, молекулу углекислого газа в виде
2H2 + O2 = 2H2O (две молекулы водорода и одна молекула кислорода дают две молекулы воды; заметим по поводу этой формулы, что обыкновенный водород состоит из молекул, содержащих каждая по два водородных атома, и подобным же образом кислород состоит из молекул, каждая из которых составлена из двух атомов кислорода). Горение черного пороха может быть представлено формулой 2KNO3 + S + ЗС = K2S + N2 + ЗСО2 (две молекулы калийной селитры, атом серы, три атома углерода, соединяясь, дают молекулу сернистого калия, молекулу азота и три молекулы углекислого газа). Еще удобнее было бы (хотя, впрочем, это мало принято у химиков) вместо знака = писать стрелку →, отчетливее указывающую направление химического превращения; обе реакции, которые в виде примера были только что написаны, при этом приняли бы вид 2Н2 + O2→ 2Н2O, 2KNO3 + S + ЗС → К2S + N2 + 3CO2. После всех этих предварительных разговоров и объяснений приводим таблицу ныне известных химических элементов и их атомных масс. Не преувеличивая, можно сказать, что эта небольшая таблица, помещающаяся на одной-двух страницах, представляет концентрированный результат упорнейшего труда многих поколений химиков, со времен Берцелиуса и до наших дней. (Порядок, в котором в этой таблице расположены элементы, выбран не случайно: элементы расположены в порядке растущей атомной массы.) Спросим себя, что же стало с гипотезой Праута, которая была основана на том, что атомные массы элементов — точные целые числа? Осталось ли что-нибудь от этой гипотезы? Увы, не только весьма точные современные числа не подтверждают мнения Праута о целочисленности атомных масс, но даже и первые измерения Берцелиуса показали, что не все атомные массы являются целыми числами. Таблица химических элементов, их символов и атомных масс. 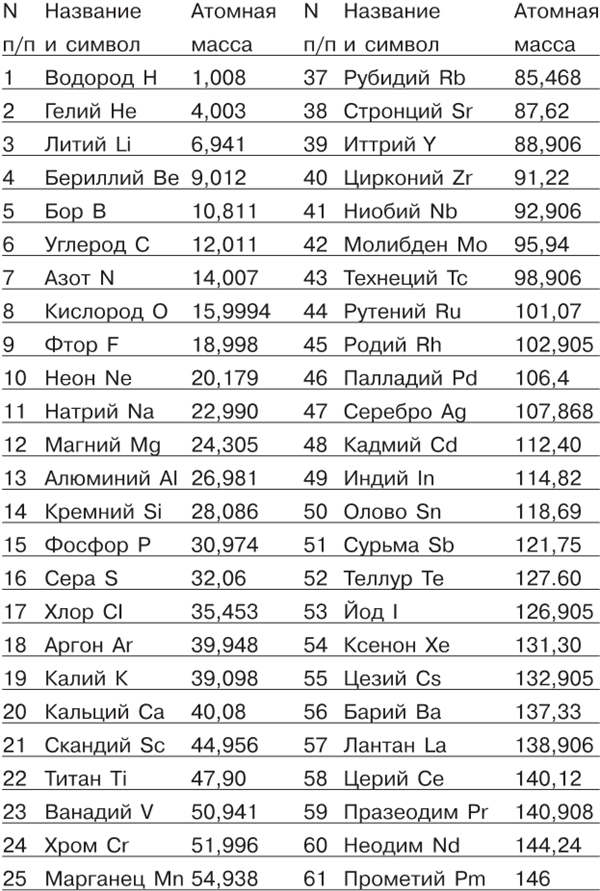
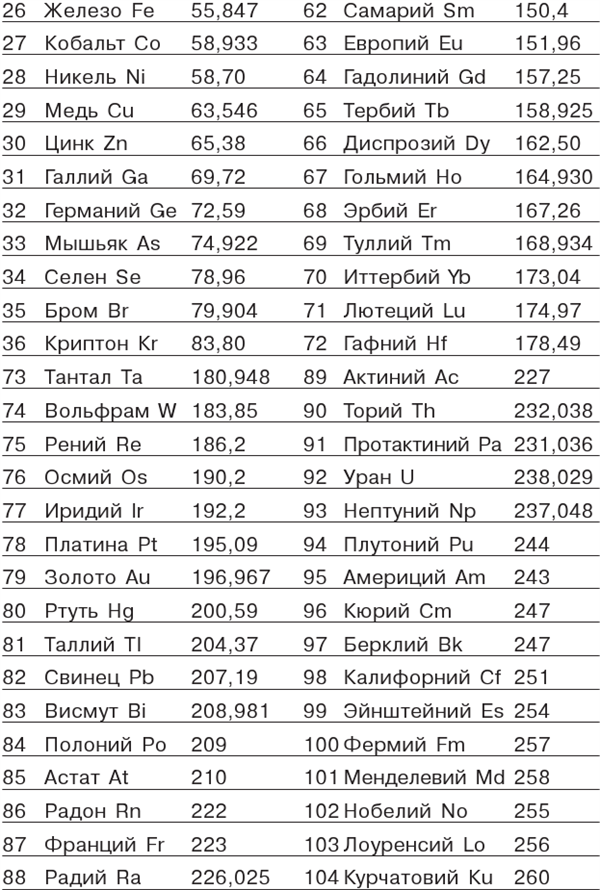
Примером может служить хлор, атомная масса которого равна 35,453 (в таблице Берцелиуса, составленной в 1826 году, атомная масса хлора 35,4). Поэтому гипотеза Праута в том виде, в каком он ее сформулировал, безусловно должна быть отброшена. Заметим все же, просматривая нашу таблицу, что очень многие атомные массы, особенно в начале таблицы, весьма близки к целым числам, иногда в точности им равны, например, у фтора и углерода, а иногда отличаются от них меньше чем на 0,01, например, у водорода, гелия, азота, натрия и т. д. Это странное обстоятельство заставляет как будто отнестись с некоторым вниманием к гипотезе Праута, так как трудно себе представить, чтобы это могло быть результатом чистого случая, но тем не менее такие атомные массы, как у магния или хлора, не говоря уже о многочисленных элементах с большими атомными массами, все-таки принуждают отбросить предположение о том, что все атомы состоят из атомов водорода. Поэтому в XIX столетии совершенно укрепилось и распространилось представление о том, что все тела в мире состоят из этих нескольких десятков сортов атомов, которые являются совершенно независимыми друг от друга основными элементами мироздания. Атомы вечны и неразрушимы и не могут превращаться друг в друга. «Даже когда Солнечная система распадется и на ее развалинах возникнут другие миры, атомы, из которых она состоит, останутся целыми и неизношенными», — так сказал в 1873 году в одной речи знаменитый английский физик Джеймс Клерк Максвелл, основатель современной теории электрического и магнитного полей. Из этой цитаты видно, как нераздельно властвовали в физике идеи Дальтона даже через несколько десятилетий после появления его «Химической философии».
|


 , а просто внизу приписывается цифра, указывающая число атомов; например, та же молекула углекислого газа, состав которой Дальтон случайно угадал правильно, пишется в виде СO2 (С — углерод, О — кислород), молекула воды записывается Н2O, молекула аммиака — NH3 и т. д. Упрямый Дальтон до конца жизни (он умер в 1844 году) не хотел принять обозначений Берцелиуса (как из того же упрямства он не хотел принять и его точных атомных масс, предпочитая свои, неточные). Ворча, он говорил, что легче изучить древнееврейский язык, чем понять что-нибудь в химических формулах Берцелиуса. Но мы можем наглядно убедиться в удобстве обозначений Берцелиуса на примере молекулы тростникового сахара, которая по системе Берцелиуса записывается формулой С12Н22О11 (12 атомов углерода, 22 атома водорода, 11 атомов кислорода); по Дальтону же пришлось бы нарисовать сорок пять кружков, двенадцать из них зачернить, а в двадцати двух поставить в середине точку. Обозначения Берцелиуса позволяют также легко записать в виде формулы и то, что происходит при химической реакции: это записывают обыкновенно в виде равенства, где слева стоит все, что было до реакции, а справа — все, что стало после реакции. Например, горение водорода в кислороде, дающее в результате воду, пишется в виде уравнения
, а просто внизу приписывается цифра, указывающая число атомов; например, та же молекула углекислого газа, состав которой Дальтон случайно угадал правильно, пишется в виде СO2 (С — углерод, О — кислород), молекула воды записывается Н2O, молекула аммиака — NH3 и т. д. Упрямый Дальтон до конца жизни (он умер в 1844 году) не хотел принять обозначений Берцелиуса (как из того же упрямства он не хотел принять и его точных атомных масс, предпочитая свои, неточные). Ворча, он говорил, что легче изучить древнееврейский язык, чем понять что-нибудь в химических формулах Берцелиуса. Но мы можем наглядно убедиться в удобстве обозначений Берцелиуса на примере молекулы тростникового сахара, которая по системе Берцелиуса записывается формулой С12Н22О11 (12 атомов углерода, 22 атома водорода, 11 атомов кислорода); по Дальтону же пришлось бы нарисовать сорок пять кружков, двенадцать из них зачернить, а в двадцати двух поставить в середине точку. Обозначения Берцелиуса позволяют также легко записать в виде формулы и то, что происходит при химической реакции: это записывают обыкновенно в виде равенства, где слева стоит все, что было до реакции, а справа — все, что стало после реакции. Например, горение водорода в кислороде, дающее в результате воду, пишется в виде уравнения Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно