
|
||
|
|
||
|
|
Онлайн книга - Механизм Вселенной: как законы науки управляют миром и как мы об этом узнали | Автор книги - Скотт Бембенек
Cтраница 42

По-видимому, в этой схеме есть неточность, поскольку в результате процесса у нас остаются атомы водорода. Это было бы нормально, если бы мы знали, что так и происходит, но экспериментальные свидетельства показывают, что нет. Давайте исключим из нашего процесса уравнение Дальтона – в конце концов, это были всего лишь его размышления. Вместо этого допустим, что атомы одного и того же элемента в газообразном состоянии могут объединиться, чтобы формировать молекулы, как считал Авогадро, а не существуют в виде отдельных атомов, как того требовал Дальтон. 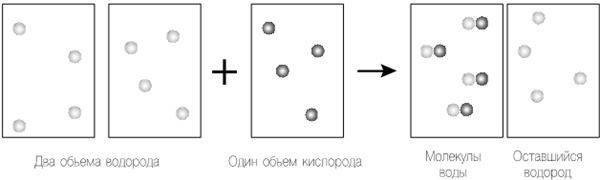
Рисунок 12.1. Следуя теории Гей-Люссака, мы берем два объема водорода, объединяющихся с одним объемом кислорода для создания одного объема водяного пара. Далее мы применяем уравнение Дальтона для объединения объемов. Поскольку объем, давление и температура объемов одинаковы, мы применяем закон Авогадро, сохраняя одинаковое число «частиц», которые в этом случае являются отдельными атомами в каждом объеме. А именно, давайте предположим, что в водороде и кислороде два отдельных атома объединяются, чтобы сформировать двухатомные молекулы H2 и O2 соответственно, а не просто существуют как отдельные атомы H и O. Теперь вернемся к нашему эксперименту, используя только результаты Гей-Люссака для объединенных объемов и закон Авогадро (рис. 12.2). Так как мы исключили уравнение Дальтона, мы просто возвращаемся к закону Авогадро и используем одинаковое количество частиц в каждом объеме. Единственное оставшееся у нас требование Гей-Люссака напоминает нам, что все атомы водорода и кислорода превратятся в итоге в водяной пар; другими словами, у нас не может остаться свободных атомов, как было прежде. И вот тут мы наблюдаем нечто интересное. Если мы считаем истинными теории Гей-Люссака и Авогадро, мы видим, что формулой молекулы воды является H2O – не HO, как считал Дальтон. 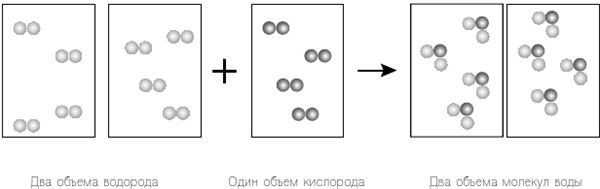
Рисунок 12.2. Еще раз рассмотрим результаты исследований Гей-Люссака вместе с законом Авогадро. Однако на этот раз мы игнорируем уравнение Дальтона и вместо этого предполагаем, что водород и кислород существуют как двухатомные молекулы, H2 и O2 соответственно. Это соответствует теории Гей-Люссака и закону Авогадро, и в результате не остается «лишних» атомов. Однако мы в некотором смысле сжульничали; в конце концов, мы предположили, что кислород и водород существуют как двухатомные молекулы. Мы знаем, что это действительно так, но во времена Дальтона это было неизвестно. Даже с исключением допущения Дальтона и применением результатов Гей-Люссака с законом Авогадро у нас остается еще множество вариантов. Все, что мы сделали, так это обнаружили один достаточно хорошо (и, как известно сегодня, правильно) работающий принцип. Таким образом, остается вопрос: как мы согласуем все эти методы и результаты? В то время как закон объемных отношений Гей-Люссака и закон Авогадро решают не только проблему того, как соединяются водород и кислород при образовании воды, они все же вынудили нас отклонить предположение Дальтона о том, как объединяются атомы (правило наибольшей Дальтона). Более того, изучая различные реакции, а не только одну, как это сделали мы, можно достигнуть соответствия между разными реакциями, придя к правильным химическим уравнениям. На самом деле у Авогадро было собственное простое правило. Он утверждал, что верное уравнение для данной химической реакции будет согласовываться с уравнениями других связанных химических реакций, а также результатами Гей-Люссака и его, Авогадро, законом. Закон Авогадро был совершенно новым взглядом на атомы газа. То, что у газов при равном объеме, температуре и давлении одинаковое количество частиц, будь это атомы или молекулы, также означало, что внутри газа имеется большое количество свободного пространства и что атомы не находятся в постоянном контакте друг с другом. Далее, предполагая, что атомы газа могут объединиться, формируя молекулы, бросало вызов популярной идее, что одинаковые атомы могут только отталкивать друг друга. В 1811 году эта идея были не слишком популярна, а Авогадро не предложил разумного доказательства. Он не вычислил и не определил экспериментально количество частиц, занимающих данный объем при постоянном давлении и температуре, чтобы показать, что оно одинаково независимо от вида частиц. По этой причине идеи Авогадро оставались забытыми в течение почти полувека. Понятие атома и его роли в химии все еще оставалось предметом открытого спора. В целом все были согласны, что предположение, будто вещество состоит из атомов, было хорошим инструментом для химических реакций и наглядного отображения структур молекул, которые формировались. Означало ли это, что вещество по природе состоит из неделимых микроскопических частиц, которые следует называть атомами, – было совсем другим вопросом. Нехватка однозначного метода для определения относительной (и, конечно, абсолютной) массы атомов и молекул и их химических формул привела к возникновению нескольких несовместимых атомных теорий. Тем не менее атомная теория, так или иначе, внесла свой вклад в химию. Поворотный момент наступил в 1858 году (спустя два года после смерти Авогадро), когда Станислао Канниццаро опубликовал статью, показывающую, что работа Авогадро, за незначительными исключениями из общего правила, позволяла определить относительные массы многих веществ, существующих в газообразном состоянии. Вспомните, что подход Дальтона требовал знания количества исходных материалов, используемых в химической реакции при создании интересующей молекулы, и предположения, из скольких атомов состоит молекула. Подход, предложенный Канниццаро, сокращал процесс определения относительной атомной массы до почти тривиального измерения удельного веса . К сожалению, статья Канниццаро в научном сообществе сперва привлекла внимание очень немногих. Но скоро это изменилось. В 1860 году Канниццаро выступал на международной химической конференции, проходившей в немецком городе Карлсруэ. Его речь произвела большое впечатление на аудиторию, состоявшую главным образом из выдающихся европейских химиков. Позже друг Канниццаро Анджело Павези раздал ту самую брошюру со статьей Канниццаро посетителям. Систему Канниццаро, основанную на законе Авогадро, вскоре приняли. Успех Канниццаро, утвердившего работу Авогадро как первостепенную в рамках атомной теории, был обязан точным вычислениям. Однако, пожалуй, самым значительным фактором послужило то, что в отличие от Авогадро, Канниццаро обеспечил (практически тривиальные) экспериментальные средства, позволяющие проверить гипотезу. Следовательно, то, что прежде было всего лишь предположением, теперь можно было легко проверить и внедрить. Более того, это произошло в самый подходящий момент. |
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно