
|
||
|
|
||
|
|
Онлайн книга - Механизм Вселенной: как законы науки управляют миром и как мы об этом узнали | Автор книги - Скотт Бембенек
Cтраница 41

Таким образом мы закончим с двумя коробками равного размера (объема), которые содержат одинаковое количество «частиц». Конечно, атомы действительно ведут себя иначе, чем баскетбольные мячи или мячи для гольфа, но в этом случае (будьте уверены) наша аналогия по форме абсолютно верна. Таким образом, если мы сможем сосчитать количество малых и больших частиц в двух разных шарах, то обнаружим, что шары одинаковы по размеру и количество больших внутри одного равно количеству малых частиц внутри другого, а также что внутри довольно много оставшегося свободного пространства. Как вы видите, частицы (атомы, молекулы или их смесь) газа расположены не так уж плотно по отношению друг к другу. Скорее они находятся в движении, перемещаясь в окружающем их вакууме. Действительно, модель атомов в свободном пространстве уже знакома нам из древнегреческих атомных теорий Демокрита и Эпикура. Закон Авогадро о равных количествах частиц для равных объемов при постоянной температуре и давлении значительно продвинул понимание природы газов. Авогадро никогда не доказывал свою теорию, он также не мог определить фактическое количество частиц при определенной температуре или давлении. Однако закон Авогадро следует из кинетической теории газов. Основываясь на кинетической теории газов, можно рассчитать среднюю полную поступательную кинетическую энергию (Eк) идеального газа при температуре T и количестве частиц N при помощи уравнения 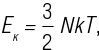
где k – просто константа, известная как постоянная Больцмана. Поступательная кинетическая энергия – кинетическая энергия, связанная с движением по осям x, y или z (направления измерения длины, ширины и высоты). Этот результат, который можно прямо получить при помощи распределения Максвелла (как обсуждалось в части 2), показывает, что Eк не зависит от массы частиц или их типа, но зависит только от температуры. Это означает, что при равной температуре, если два объема различных газов содержат то же количество частиц, у обоих объемов значение Eк будет одинаковым. Другой вывод из кинетической теории газов состоит в том, что давление P идеального газа в объеме V можно описать при помощи уравнения P = 2 / 3V · Eк, или, проще, P = NkT / V после подстановки одной из формул, приведенных выше, в другую. Учитывайте, что два различных газа обозначены как 1 и 2. Их соответствующие выражения для давления будут: P1 = N1kT1 / V1 и P2 = N2kT2 / V2. Поэтому если два разных идеальных газа имеют равные объемы, давление и температуру, то количество их частиц будет равным, так как имеется равенство P1 = P2, где объем и температура одинаковы при условии N1kT / V = N2kT / V, или попросту N1 = N2. Это и есть закон Авогадро. Однако реальные газы отличаются от идеальных газов тем, что частицы в них претерпевают воздействия притяжения и отталкивания. Как следствие, в реальных газах количество частиц равняется числу Авогадро, только когда они ведут себя «идеально», что происходит при низком давлении и/или высоких температурах. Сегодня мы узнаем закон Авогадро по фундаментальной константе, названной числом Авогадро – это количество частиц в одном моле вещества. Один моль любого вещества – количество вещества (в граммах), которое равно его атомной массе. Например, атомный вес углерода составляет 12 граммов на моль, и поэтому 1 моль углерода равняется 12 граммам. Другой пример – вода, атомный вес которой 18 граммов на моль, и поэтому 18 граммов воды (или приблизительно одна столовая ложка) – это один моль воды. Хотя Авогадро говорил всего лишь о количестве частиц в объеме газа , числом Авогадро называется число частиц, в определенном количестве вещества (один моль), и оно применимо к газу, жидкости и твердому телу. В 1909 году Жан Батист Перрен (1870–1942) впервые экспериментально определил число Авогадро, изучая броуновское движение (позже мы обсудим это более подробно), и получил результат 6,7 · 1023 частиц/моль. Он был первым, кто связал его со значением моля вещества и предложил назвать его в честь Авогадро. Сегодня значение определено более точно – 6,022 · 1023 частиц/моль . Идеальный газ при 32 °F и атмосферном давлении заполнил бы объем (воздушный шар), равный 22,4 литра и содержал бы ровно 6,022 · 1023 частиц. Авогадро думал, что газ, состоящий из одного элемента (как кислород, водород, азот и т. д.), мог состоять из молекул, тогда как Дальтон настаивал, что они могли существовать только как атомы. В то время было принято считать, что атомы одного элемента отталкивают друг друга, тогда как атомы разных элементов притягивают друг друга. Идеи Авогадро явно противоречили этому. Далее, если бы атомы одного элемента на самом деле притягивали друг друга, то было бы непонятно, что останавливало их от слияния и перехода в жидкое агрегатное состояние. Сегодня мы знаем, что атомные взаимодействия имеют разные виды и силу, что позволяет одним элементам притягивать друг друга в определенной мере. Закон Авогадро и тот факт, что атомы одного элемента в газе могут сформировать молекулы, позволяет нам объяснить закон объединяющихся объемов Гей-Люссака. Вспомните результат исследования Гей-Люссака по образованию водяного пара из кислорода и водорода: 2 объема газа водорода + 1 объем газа кислорода → 2 объема водного пара. Вспомните, Дальтон считал, что верное уравнение смешения отдельных атомов в общем объеме выглядит так: 1 атом водорода + 1 атом кислорода → 1 молекула водного пара. Другими словами, Дальтон думал, что образование водяного пара происходит с помощью одного атома водорода, объединяющегося с одним атомом кислорода – вместе они формируют одну молекулу воды. Поэтому, если у нас есть объем вещества, содержащий несколько атомов кислорода и несколько атомов водорода, согласно теории Дальтона процесс будет происходить до тех пор, пока все атомы не разделятся на пары. Давайте попытаемся совместить уравнение Дальтона и результаты исследования Гей-Люссака. Возьмем одинаковое количество атомов в равных объемах газа (при одинаковых температуре и давлении) в соответствии с законом Авогадро. На рис. 12.1 у нас есть правильные величины объемов каждого газа, вовлеченных в химическую реакцию, как это определил Гей-Люссак, взаимодействующие по правилам уравнения Дальтона. Далее, так как мы используем закон Авогадро, количество атомов в каждом объеме должно быть одинаковым, но какое именно это количество – неважно. |
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно