
|
||
|
|
||
|
|
Онлайн книга - Эпоха дополненной реальности | Автор книги - Бретт Кинг
Cтраница 51

Персонализированная и прецизионная медицина Исследователи Университета Вашингтона в Сент-Луисе не так давно сравнили последовательности ДНК [262] здоровых людей и трех пациентов с меланомой на поздней стадии. Вычленив уникальные мутации в генах клеточных белков у каждого из трех больных, исследователи сумели создать вакцины, способствующие повышенной выработке у пациентов Т-лимфоцитов, убивающих раковые клетки. 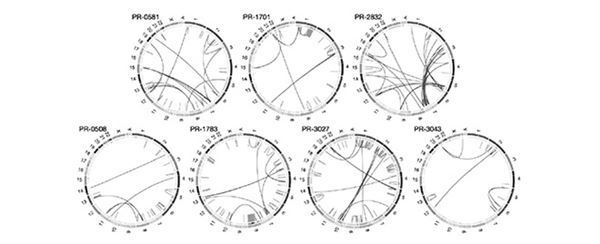
Рисунок 5.10. Семь нуклеотидных последовательностей, связанных с развитием рака простаты (источник: Nature Medical Journal, 470, № 7332, февраль 2011 года) Современные исследования в области персонализированной медицины, конечно же, сфокусированы на анализе генома пациента, но при этом учитываются и дополнительные факторы влияния на его здоровье – экологические, социальные, биометрические и даже религиозные. Только с их учетом подбирается индивидуальная схема лечения в каждом конкретном случае. Таким образом, медицинская наука переживает сегодня фундаментальный сдвиг с позиции подхода к лечению по принципу «это средство подойдет всем» к индивидуальному подбору препаратов по результатам анализа структуры вашей ДНК, биохимического анализа крови и оценки возможных реакций вашего организма на различные химические воздействия при определении дозировок и длительности курсов медикаментозной терапии. Рассмотрим лишь одну из возможностей подобного рода, касающуюся подбора дозировки и силы препаратов из категории антидепрессантов. Сегодня врачи назначают схемы лечения методом проб и ошибок, неделями наблюдают за пациентами, после чего корректируют состав и дозировку психотропных средств, пока не подберут оптимальную – и то лишь по их мнению. Основанная на результатах генетического анализа информация позволит врачам подбирать и прописывать пациентам лишь самые действенные лекарства – и в точных дозировках, вытекающих из результатов ДНК-анализа. При таком подходе вместо использования, например, произвольно выбранного селективного ингибитора обратного захвата серотонина можно будет подобрать средство, стимулирующее организм пациента к саморегулированию уровня серотонина (и/или иных нейромедиаторов) в пределах нормы, характерной для его генотипа. Аналогичные прорывы в ближайшее время ожидаются и в категориях обезболивающих, противовоспалительных, противоэпилептических и ряда других лекарственных средств. По мере совершенствования возможностей генетического секвенирования мы начинаем понимать, что знания тканевой локализации онкологического процесса (например, определения заболевания как «рак простаты») недостаточно для безошибочного выбора эффективного лечения. Последние исследования показали, что один и тот же тип ракового заболевания у каждого отдельно взятого пациента может протекать по-разному в силу генетических особенностей организма. Таким образом, индивидуальный подход к подбору лечения – обязательная характеристика медицины будущего. При этом использование методов прикладной геномики [263] – лишь одна из множества возможностей для создания реально работающей модели персонифицированной медицины. Жизненно важным будет обеспечение доступа медиков к исчерпывающему массиву данных о вас и вашем здоровье, – учитывая медицинский, семейный и наследственный анамнез, все места вашего проживания с указанием точных сроков, воздействий окружающей среды, которым вы регулярно подвергаетесь, все результаты ранее бравшихся у вас анализов, предыдущие реакции вашего организма на различные лекарства и множество другой информации подобного рода. Эти данные будут просто необходимы для целенаправленной и безошибочной диагностики вашего состояния или заболеваний и точного выбора лекарств нацеленного действия. Для успешного повсеместного распространения практики персонифицированной медицины, скорее всего, потребуется открыть врачам общий доступ к централизованным базам данных электронных историй болезни граждан. Если же вас не устраивает перспектива разглашения медикам данных об имевшихся у вас проблемах со здоровьем, прошлых местах жительства и работы, пройденных курсах лечения и т. п., готовьтесь с этим смириться или отказаться от возможности полноценного лечения, поскольку медицина будущего – это прежде всего генетический анализ, сенсорные датчики и базы данных. «Биодополнение» Если вам хочется понять, как именно работает генная терапия и чем она дополняет нашу наследственную биологию, попробуйте мысленно уподобить свой генетический код компьютерной программе. В ваши ДНК вшиты всевозможные командные строки, которые в совокупности и определяют то, чем вы являетесь. И если в наследство от родителей или прародителей нам досталась ДНК, кодирующая недостаточно высокую выработку какого-либо белка, или с генами каких-либо системных нарушений, или с нехваткой генов, препятствующих другим болезням, то мы с высокой вероятностью можем ждать развития наследственно обусловленного заболевания. Если мы научимся «редактировать» этот код и вставлять его обратно в ДНК в «отремонтированном» виде и на правильное место в цепочке, – значит, мы восполнили генетический пробел или, выражаясь более простым языком, исправили ошибку. Системы редактирования геномов CRISPR/Cas9 и TALEN В 1987 году биологи обнаружили у бактерий естественный защитный механизм от встраивания вирусов в цепочки ДНК. А в 2000–2002 годах ученые к тому же установили, что бактерия не ограничивается защитной реакцией, а контратакует вторгшийся вирус, перерабатывая и расщепляя его ДНК на составляющие. Этот иммунитет получил название CRISPR – сокращение от английского «clustered regularly interspaced short palindromic repeats» («короткие палиндромные повторы, регулярно расположенные группами»). В период с 2009 по 2012 год исследовались возможности CRISPR разрезать вирусную ДНК белками иммунной системы бактерий. Так был открыт белок Cas9 (сокращение от «CRISPR associated protein 9» – «CRISPR-ассоциированный белок 9»). Он представляет собой не просто белок, а эндонуклеазу то есть фермент, способный вносить в ДНК точечные разрезы. В структуре Cas9 имеются два активных участка (HNH и RuvC), играющих роль биохимических «ножниц» для обеих нитей ДНК. К 2012 году была выработана гипотеза, согласно которой нуклеазу Cas9 можно использовать в качестве инструмента редактирования генома в рамках генной инженерии клеточных культур человека с целью идентификации и вырезания из геномной последовательности участков, программирующих предрасположенность человека к развитию различных наследственных заболеваний, включая болезни Паркинсона и Альцгеймера, диабет, наследственно обусловленные онкологические заболевания (такие, как рак молочной железы), некоторые формы иммунодефицита и т. д. В наши дни исследования в области генной терапии уже перешли в практическую плоскость и сфокусированы на разработке прикладных методов лечения моногенных (то есть обусловленных одним геном) заболеваний.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно