
|
||
|
|
||
|
|
Онлайн книга - Карнавал молекул | Автор книги - Михаил Левицкий
Cтраница 24

Итак, на примере того, как удалось осуществить невозможную реакцию, мы познакомились с умением химиков обходить запреты, налагаемые законами природы. 3
Вечная забота химика Забота государства о людях познается по районным поликлиникам. МИХАИЛ ЗАДОРНОВ Химик постоянно занимается тем, что «ставит» различные реакции, именно так и говорят – не «осуществить» или «провести», а «поставить». Во-первых, важно, чтобы реакция «пошла», а если идет слишком медленно, то хорошо бы ее убыстрить. Обе эти задачи успешно решает удачно найденный катализатор. Это вещество, добавленное в реакционную смесь, ускоряет процесс, но само при этом не расходуется. Например, выберем случай, когда вещества А и Б не реагируют или реагируют очень медленно (рис. 3.1). 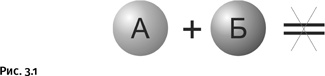
Ситуацию может исправить катализ: вещество А реагирует вначале с катализатором, образуя некое «временное соединение» – так называемый переходный комплекс А – катализатор. Затем этот комплекс реагирует с веществом Б, образуется нужное соединение А – Б, а катализатор высвобождается и может далее принимать участие в образовании следующей молекулы А – Б (рис. 3.2). 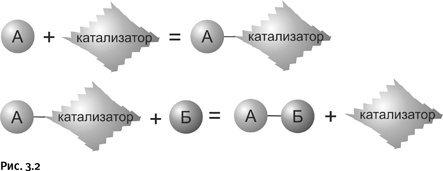
Все эти представления о катализе, рассказанные буквально в четырех строках, возникли далеко не сразу. В 90-х гг. XVIII в. французские химики Никола Клеман и Шарль Бернар Дезорм изучали процесс получения серной кислоты окислением серы. Образующийся при сжигании серы диоксид SO2 необходимо окислить до серного ангидрида SO3, который при растворении в воде образует серную кислоту H2SO4. В качестве «передатчика» кислорода диоксиду серы были использованы оксиды азота. При этом ученые отметили, что количество оксидов азота в ходе процесса не изменяется. Это было первое описание каталитического процесса. Постепенно количество наблюдаемых реакций, ускорение которых происходило в присутствии различных веществ, увеличивалось. В 1811 г. российский химик К.С. Кирхгоф открыл реакцию превращения крахмала в глюкозу в присутствии кислоты, количество которой в ходе реакции существенно не уменьшалось. Французский химик Луи Жак Тенар описал в 1818 г. распад аммиака NH3, а также перекиси водорода на некоторых металлах и оксидах, которые при этом не претерпевают никаких изменений. Г. Дэви и И.В. Деберейнер, проведя в 1816–1821 гг. серию исследований, установили, что порошкообразная платина многократно ускоряет присоединение водорода к кислороду, а также окисление органических соединений кислородом. Шведский химик Й.Я. Берцелиус (рис. 3.3) сумел разглядеть в этих, казалось бы, несхожих работах нечто общее, и в 1835–1836 гг. он опубликовал серию обобщающих работ, назвав наблюдаемое явление катализом (от греч. κατάλυσις – разложение). 
Научные основы катализа заложил немецкий химик В. Оствальд (рис. 3.4), получивший в 1909 г. Нобелевскую премию по химии «за работы по катализу, а также за исследования основных принципов управления химическим равновесием и скоростями реакции». Он определил катализатор как «вещество, которое изменяет скорость реакции, не появляясь в конечном продукте реакции». Для оценки каталитического действия Оствальд предложил измерять скорости реакций. Фактически он создал новую дисциплину – кинетику, т. е. раздел химии, изучающий скорости реакций. Долгое время катализ представлял собой смесь науки и искусства; в поисках нужных катализаторов неутомимая армия химиков-энтузиастов перепробовала тысячи различных веществ, в результате были найдены катализаторы, которые успешно работают и в наши дни. 
Наиболее интересная сторона катализа – специфичность, т. е. способность вести реакцию в строго определенном направлении. Например, монооксид углерода СО (угарный газ) и водород Н2 в обычных условиях не взаимодействуют. А в присутствии медьсодержащего катализатора происходит следующее. Вначале молекулы СО и Н2 адсорбируются на катализаторе (поглощаются поверхностью), что обозначено пунктиром на рис. 3.5. При этом молекулы водорода разделяются на атомы, оставаясь связанными с поверхностью катализатора. Это и есть самая главная роль катализатора – ослабить связи между атомами в молекуле. К катализатору присоединяется также молекула СО. Образуется переходный комплекс, который перегруппировывается (показано изогнутыми стрелками). Атомы Н присоединяются к атомам С и О, все заканчивается образованием метанола СН3ОН. 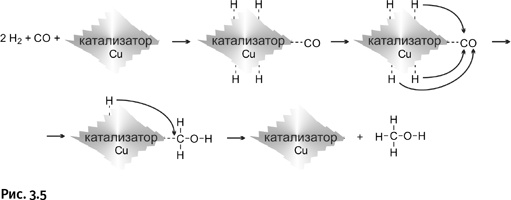
Возьмем те же самые соединения СО и Н2. Реакция протекает иначе, если заменить медьсодержащий катализатор никелевым. В этом случае на поверхности катализатора распадаются на атомы не только молекулы водорода, но и молекула СО. Затем четыре атома Н присоединяются к атому С, а два атома Н – к атому О. В результате образуются метан СН4 и вода Н2О (кстати, так можно обезвредить ядовитый угарный газ СО) (рис. 3.6). 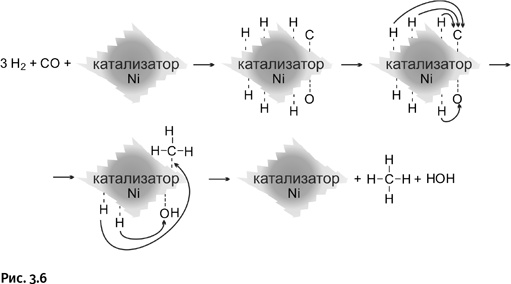
Как видно из показанных схем, катализатор в обоих случаях высвобождается. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами, участвуют в проведении биохимических реакций. Без катализаторов не могли бы протекать многие промышленные процессы. Познакомимся с некоторыми интересными исследованиями в этой области. Азот недоступный, но необходимый
Азот – это вечный источник танталовых мук человечества, вечные терзания голода среди роскошного изобилия. АМЕРИКАНСКИЙ БИОХИМИК М. КАМЕН Вероятно, не существует другого такого химического элемента, который доставил бы человечеству столько хлопот. Необычность ситуации состоит в том, что запасы молекулярного азота N2 громадны, поскольку это основная составная часть воздуха – его содержание в земной атмосфере свыше 78 % по объему, что соответствует 4 × 1015 т. На рисунке 3.7 показаны шары, объемы которых приблизительно соответствуют содержанию основных газов в атмосфере. Для многих, вероятно, окажется неожиданным, что содержание аргона Ar в воздухе заметно выше, чем углекислого газа СО2.
|

 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно