
|
||
|
|
||
|
|
Онлайн книга - От атомов к древу. Введение в современную науку о жизни | Автор книги - Сергей Ястребов
Cтраница 64

Как же это работает? Возьмем для примера какую-нибудь химическую реакцию, прекрасно идущую самопроизвольно, например реакцию водорода (H2) с кислородом (O2). Если эти газы смешать и нагреть, произойдет весьма впечатляющий взрыв, в результате которого водород с кислородом соединятся, образовав воду (H2O). Вот уравнение этой реакции: H2 + ½O2 → H2O Коэффициент ½ перед кислородом тут означает, что для образования любого данного количества воды нужно вдвое меньше молекул кислорода, чем молекул водорода. Ну а изменение энергии Гиббса для этой реакции будет следующим: ΔG = –237,6 кДж/моль Поскольку это намного меньше нуля, то самопроизвольное протекание реакции вполне возможно, что, собственно, и будет наблюдать каждый, кто умудрится поджечь водород. Между прочим, именно из-за большого отрицательного изменения энергии Гиббса в этой реакции происходили все пожары и взрывы водородных дирижаблей, в том числе знаменитая катастрофа германского дирижабля “Гинденбург”, погибшего над Северной Америкой в 1937 году. Если уж летать на дирижаблях, то гораздо лучше наполнять их гелием, который с кислородом не реагирует. “Гинденбург” погиб потому, что немцам в 1930-х годах добыча промышленных количеств гелия была недоступна: на Земле, в отличие от космического пространства, это очень редкий газ. Ну а теперь вернемся к АТФ. Вернее, не только к нему. Дело в том, что кроме полифосфатов и нуклеозидтрифосфатов (АТФ, ГТФ, УТФ, ЦТФ...) в биохимии встречается и много других молекул, содержащих фосфатные группы. Как правило, фосфат может отрываться от такой молекулы с участием воды, то есть путем гидролиза (разрыв фосфоангидридной связи в АТФ — это и есть типичный пример гидролиза). И эта реакция сопровождается снижением свободной энергии, а значит, может идти самопроизвольно. Но точная величина ΔG тут будет для каждого соединения своя. Рассмотрим еще две молекулы, содержащие фосфат, но совсем не родственные АТФ по структуре. Первая из них — фосфоенолпируват, трехуглеродная молекула с карбоксильной группой и двойной связью (производное пировиноградной кислоты). Вторая — глицерофосфат, трехуглеродная молекула с двумя гидроксильными группами и без двойных связей (производное спирта глицерина). Обе эти молекулы могут отдавать фосфат путем гидролиза, точно так же, как и АТФ. Вот упрощенные уравнения этих реакций: АТФ + H2O → АДФ + фосфат глицерофосфат + H2O → глицерин + фосфат фосфоенолпируват + H2O → пируват + фосфат Во всех этих реакциях происходит один и тот же процесс, а именно отрыв фосфата. Изменение свободной энергии, однако, в этих трех случаях будет совершенно разным. Давайте посмотрим на цифры. Для гидролиза глицерофосфата ΔG = –9,2 кДж/моль. Для гидролиза АТФ ΔG = –31,8 кДж/моль. И наконец, для гидролиза фосфоенолпирувата ΔG = –58,2 кДж/моль. Что мы тут видим? Во-первых, все три значения меньше нуля, то есть реакции, бесспорно, самопроизвольные. Во-вторых (это тоже важно), можно заметить, что все три значения по численной величине намного меньше, чем ΔG реакции сгорания водорода (см. выше), которую можно назвать более-менее типичной для “обычной” неорганической химии. Отсюда мы видим, что перепады энергии в биохимических реакциях на самом-то деле обычно не так уж и велики. Потому что слишком большие могли бы стать разрушительными. И главное: из приведенных цифр хорошо видно, что АТФ далеко не самое высокоэнергетическое соединение из тех, что доступны обычной земной биохимии. Например, от распада фосфоенолпирувата энергетический выход гораздо больше. Видимо, от вещества-энергоносителя вовсе не требуется, чтобы порция энергии, которую несет его молекула, была огромной. Гораздо важнее, чтобы эта порция подходила для как можно большего числа процессов-потребителей и могла быть ими сразу усвоена (тогда никакая часть энергии не будет пропадать зря). Вот этому условию АТФ, надо думать, и отвечает. Как и во многих других случаях, тут выбрано не максимальное, а оптимальное значение ключевого параметра. Протоны и энергия
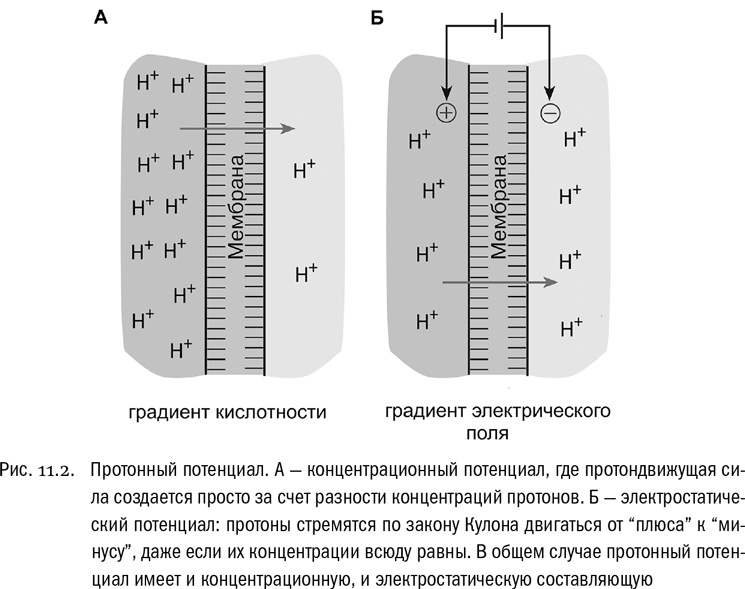
Представим себе два водных объема, разделенных мембраной. Это вполне может быть обычная липидная мембрана, изолирующая от внешней среды живую клетку или любой компартмент внутри нее (см. главы 5, 10). Нам сейчас абсолютно неважно, что по какую сторону, важно только, что мембрана отделяет друг от друга два заполненных водой “отсека”. Теперь представим, что в один из “отсеков” добавили кислоту. Кислота — это любая молекула, которая в водном растворе распадается с выделением иона водорода H+, то есть, иначе говоря, протона (см. главу 1). В результате по одну сторону мембраны станет намного больше ионов H+, чем по другую (см. рис. 11.2А). Клеточная мембрана практически непроницаема для ионов H+, если только в ней нет специальных каналов для них. Итак, по разные стороны мембраны возникнет устойчивая разность концентраций ионов H+.
Между тем известно, что при отсутствии препятствий концентрация любого вещества в любом объеме всегда стремится выравняться. Этот процесс выравнивания называется диффузией. Диффузия всегда идет самопроизвольно: любое вещество как бы само собой стремится занять весь отведенный ему объем. Это относится и к газу, который перемешали с другим газом, и к сахару, растворенному в чашке чая, и к кислоте, которая попала в воду. Но в нашем случае на пути диффузии стоит преграда. По одну сторону мембраны концентрация ионов H+ намного выше, чем по другую, и при этом пройти сквозь мембрану они не могут. Точнее, они бы еще как прошли, если бы их пропустили! И в результате существующая разность концентраций протонов обращается в запас потенциальной энергии, которую, в свою очередь, вполне можно превратить в работу. Сделать это очень просто. Нужно создать в мембране каналы, через которые протоны смогут свободно проходить. Тогда они тут же сами собой потекут с той стороны мембраны, где их больше, на ту, где их меньше. И вот энергию этого движения протонов вполне можно будет использовать для работы — для любой работы, в том числе и для синтеза АТФ. Для этого понадобится “всего лишь” ухитриться совместить протонный канал с молекулярным аналогом старинной водяной мельницы, которая будет крутиться под напором протонов, переводя их энергию в какую-нибудь другую, более полезную форму. Сама мембрана в этом случае играет роль плотины, с которой водяная мельница связана. А разность концентраций протонов аналогична разности уровня воды выше и ниже этой плотины.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно