
|
||
|
|
||
|
|
Онлайн книга - От атомов к древу. Введение в современную науку о жизни | Автор книги - Сергей Ястребов
Cтраница 23

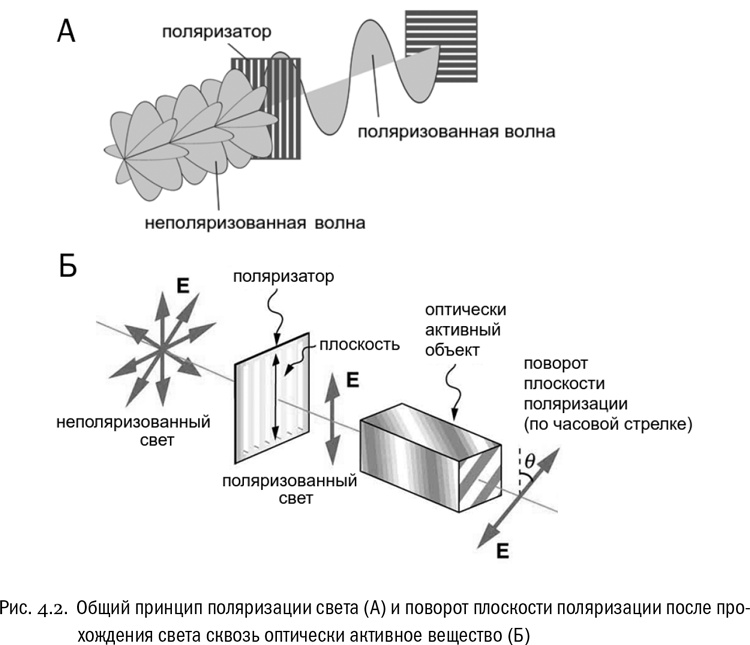
Итак, свет — это поперечная волна, где электромагнитные колебания обычно происходят сразу во многих плоскостях. Общего у этих плоскостей только то, что все они “нанизаны” на луч, по которому волна распространяется. Однако бывает и свет с колебаниями только в одной плоскости — он называется поляризованным. Такой свет можно получить, например, если пропустить обычный солнечный луч сквозь особый кристалл-поляризатор (см. рис. 4.2А). Человеческий глаз не отличает поляризованный свет от обычного, но приборы отличают (как и глаза многих животных, от пчел до осьминогов и птиц). Плоскость поляризации данного луча света остается постоянной, если только он не встретится с какими-нибудь оптическими преградами.
Теперь у нас хватает понятий, чтобы высказать ключевое утверждение. Кристаллы и растворы некоторых химических соединений обладают способностью поворачивать плоскость поляризации пропущенного сквозь них света на строго определенный в каждом случае угол (см. рис. 4.2Б). Это свойство называется оптической активностью. Как правило, оптически активными являются те вещества, у которых есть хиральность. Если у хирального соединения два стереоизомера, то их кристаллы или растворы поворачивают плоскость поляризации света на один и тот же угол, но в разные стороны. Изомер, который поворачивает плоскость поляризации по часовой стрелке, принято называть правовращающим, а против часовой — левовращающим, при этом “по часовой” или “против” определяется исходя из того, что луч света направлен воображаемому наблюдателю в лицо. Для краткости правовращающие изомеры обозначают буквой D (от лат. dexter, “правый”), а левовращающие — буквой L (от лат. laevus, “левый”). Например, два стереоизомера аланина кратко называются D-аланином и L-аланином. Все без исключения белки состоят только из L-изомеров аминокислот. Нарушить это правило невозможно: ферменты, синтезирующие белки, несовместимы с D-аминокислотами и не могут их захватывать. Таким образом, все белки на Земле обладают полной хиральной чистотой. Вот это — по-настоящему важный факт, о котором неплохо бы поговорить подробнее. Загадка левого вращения
Хиральная чистота, она же гомохиральность, — одна из главных особенностей, отличающих живые системы от неживых. Это касается не только аминокислот, но и других биологически активных соединений, у которых есть стереоизомерия (а есть она у многих). В подавляющем большинстве “обычных” химических реакций D- и L-изомеры синтезируются поровну, и разделить их потом трудно. Но в живых телах любая важная группа веществ, как правило, представлена или только L-формами, или только D-формами. Как они там разделяются, в целом понятно — с помощью ферментов, каждый из которых распознает или L-, или D-форму своего субстрата и работает только с ней. В неживых системах механизмов такого разделения или нет вовсе, или они гораздо менее эффективны. Хиральная чистота живых организмов — широко известное явление. Доходит уже и до того, что она становится темой псевдонаучных спекуляций. Вспомним пример с глутаматом — аминокислотой, которая используется как пищевая добавка и которую часто без серьезных оснований объявляют вредной для здоровья (см. главу 3). Миф об этом вреде частично основан на утверждении, что природный и синтетический глутамат — это разные стереоизомеры, один полезный, а другой опасный. Сейчас у нас вполне достаточно знаний, чтобы понять, почему это глупость. Глутамат нужен нашему организму для двух целей. Во-первых, он входит в состав белков. Во-вторых, в растворенном виде он действует на определенные белки-рецепторы, расположенные на нервных клетках мозга или на чувствительных клетках языка. Это мы уже знаем. Кроме того, мы теперь знаем, что глутамат, будучи протеиногенной аминокислотой, имеет два изомера: L-глутамат и D-глутамат. Так вот, со всеми нашими ферментами и рецепторами взаимодействует только L-глутамат. Это логично, поскольку и активные центры ферментов, и устроенные по тому же самому принципу активные центры белков-рецепторов всегда приспособлены только к одной из возможных стереоизомерных форм, в данном случае к L-форме. Что касается D-глутамата, то он ни в каких биохимических процессах толком не участвует. Можно хоть залить организм его раствором — он не подействует ни на что. Других же стереоизомеров у глутамата нет. Разумеется, ни один пищевой химик не будет добавлять в еду бесполезный и безвкусный D-глутамат. Его и синтезировать никто не станет — незачем. Весь глутамат, используемый в пищевой промышленности, — это L-изомер, идентичный “естественному” глутамату, которого в организме и так полно. Химикам, занимавшимся синтезом глутамата, пришлось изобретать сложные процедуры, чтобы получить побольше нужного L-глутамата и поменьше ненужного D-глутамата, а потом выделить первое, отбросив второе (и с этими задачами они отлично справились). Впрочем, сейчас пищевой глутамат получают микробиологическим методом — с помощью бактерий, ферменты которых изначально приспособлены к производству L-глутамата и ничего другого выдать просто не могут. И наконец, даже если бы D-глутамат попал в еду, он был бы там бесполезен (потому что у него нет вкуса) и почти наверняка безвреден. D-аминокислоты не ядовиты, они просто лишены пищевой ценности. Показано, что довольно много D-аминокислот — разумеется, небелковых — содержится, например, в молоке и сыре, и никакого вреда здоровью человека это не наносит [36]. Однако вернемся к делу. Сама по себе хиральная чистота белков легко объяснима. Мы уже знаем, насколько сильно функции белка зависят от правильного трехмерного сворачивания его аминокислотной цепочки (см. главу 3). Если синтезировать белок, используя D- и L-аминокислоты вперемешку, его пространственная укладка тут же станет непредсказуемой. Например, фермент, состоящий из случайно чередующихся D- и L-аминокислот, будет совершенно неработоспособным. Тут уж надо выбрать или только D-, или только L-изомеры — тогда объемная структура молекулы с гарантией выстроится однозначно. Но вот почему эволюция выбрала именно L-аминокислоты? Есть версия, что это чистая и беспримесная случайность. Первой на свете живой клетке почему-то достались L-аминокислоты, а дальше было проще так и оставить, чем перестраивать реакционные механизмы под другой стереоизомер. В какой-то мере оно наверняка так и было. В современном живом организме с аминокислотами имеют дело сотни ферментов, приспособленных к L-изомерам, и только к ним. Поменять все эти ферменты на приспособленные к D-изомерам было бы очень тяжелой задачей. Но если бы в самом начале пути первая живая клетка (а вернее — доклеточная система) почему-то попала в среду, обогащенную D-аминокислотами, сейчас все могло бы быть наоборот.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно