
|
||
|
|
||
|
|
Онлайн книга - Происхождение жизни. От туманности до клетки | Автор книги - Михаил Никитин
Cтраница 41

Активация нуклеозидов путем добавления к ним трех фосфатных групп катализируется рибозимом TPR1 размером 96 нуклеотидов. В качестве источника фосфора и энергии он использует триметафосфат, промежуточный продукт растворения оксида фосфора в воде, который доступен в грязевых котлах. В водно-формамидном растворе фосфорилирование нуклеозидов может происходить даже без помощи рибозимов. Нужен только самый обычный фосфатный минерал гидроксилапатит Ca5(PO4)3OH, немного солей меди и нагревание до 80 °C. Медь используется для фосфорилирования нуклеозидов и в современных клетках, она входит в состав фермента пурин-нуклеозид-киназы. 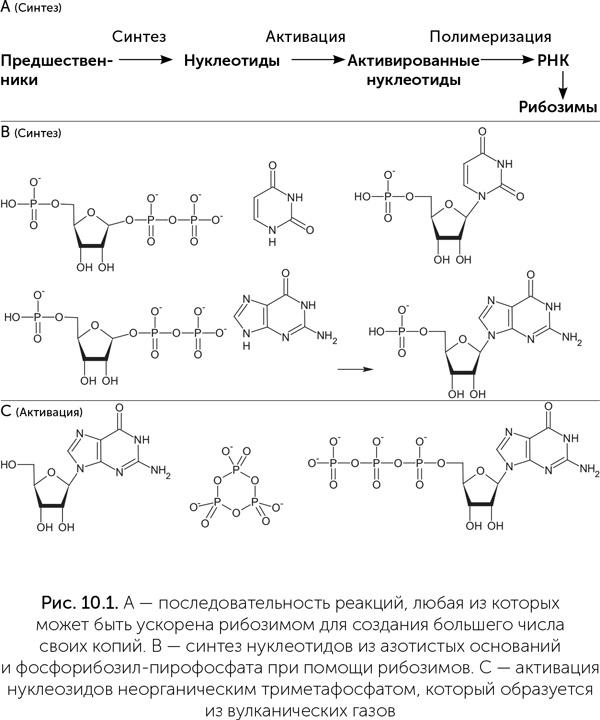
Основной шаг, повторяемый в реакции Бутлерова, называется в химии «альдольная реакция» (рис. 10.2). Рибозимы, проводящие альдольную реакцию, тоже получены в эксперименте (Chen et al., 2007). Для превращения в катализаторы им необходимы ионы цинка, подобно их функциональным белковым аналогам – альдолазам класса II. 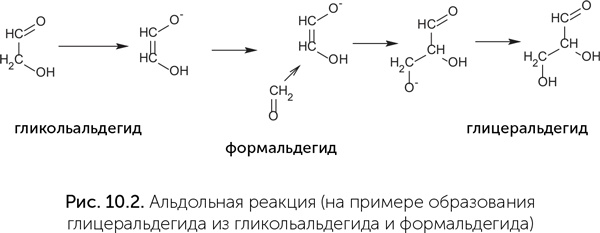
Для многих других химических реакций, нужных для производства нуклеотидов из простых молекул, возможностей чистой РНК недостаточно. Прежде всего, РНК неспособна к окислительно-восстановительным реакциям, следовательно, рибозимы не могут восстанавливать СО2 и использовать энергию окисления неорганических веществ, таких как сера, железо и водород. Белки, состоящие из 20 разных аминокислот, могут проводить гораздо больше химических реакций, но и их возможности ограничены. Более половины ферментов для работы нуждаются в дополнительных веществах – коферментах и микроэлементах. Например, для проведения окислительно-восстановительных реакций в наборе из 20 аминокислот есть цистеин, который может легко и обратимо окисляться и восстанавливаться. Однако большинство ферментов окисления и восстановления нуждаются в дополнительных веществах. Это могут быть коферменты НАД (никотинамидадениндинуклеотид) и ФАД (флавинадениндинуклеотид), железосодержащий кофермент – гем, железосерные кластеры, молибденоптериновый комплекс и ряд более экзотических веществ. РНК и витамины
Коферменты – это разнородная группа веществ, которые выполняют особые функции в биохимии и не относятся ни к одному из основных классов веществ живых организмов (белки, нуклеиновые кислоты, сахара, липиды). Организм человека не способен производить большинство коферментов из простых предшественников, поэтому мы должны получать их «заготовки» с пищей, в виде витаминов. Коферменты НАД и ФАД переносят атомы водорода и участвуют в окислительно-восстановительных реакциях. Кофермент А (КoA) работает в реакциях, связанных с переносом ацетильных групп (-CO-CH3) и других кислотных остатков. Тиаминпирофосфат принимает участие в реакциях карбоксилирования и декарбоксилирования (присоединения и отщепления углекислого газа). Цианкобаламин служит для переноса метильных (CH3) групп. Многие важнейшие коферменты имеют в своем составе адениновый нуклеотид: у кофермента А (КoA) к нему присоединена молекула витамина В5, у НАД – витамин РР, у ФАД – витамин B2 (рис. 10.3). Адениновый нуклеотид также входит в состав аденозил-кобаламина – активной формы витамина В12. Более того, у коферментов НАД и ФАД молекула в целом выглядит как два соединенных нуклеотида, где одно азотистое основание – обычный аденин, а в роли второго выступает никотинамид или флавин. Аденин в составе коферментов никак не участвует в их работе и служит только для узнавания коферментов белками. Скорее всего, это наследие РНК-мира, в котором витамины были пришиты к рибозимам для расширения их каталитических возможностей. В опытах по искусственному отбору рибозимов были получены рибозимы, катализирующие часть этапов синтеза коферментов, а именно присоединение пантетеина, никотинамид-мононуклеотида и флавин-мононуклеотида к АТФ с образованием КoA, НАД и ФАД соответственно (Jadhav, Jarus, 2002). Также известны рибозимы, которые специфически пришивают НАД, ФАД или КoA к концу своей собственной молекулы или к другой РНК. 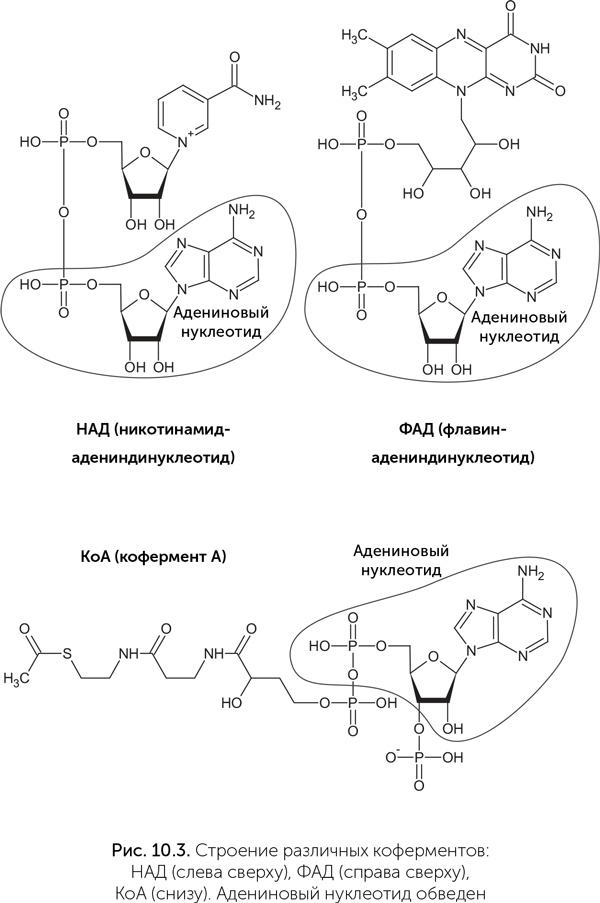
Коферменты НАД и ФАД переносят атомы водорода от одной молекулы к другой и необходимы в клетке для проведения окислительно-восстановительных реакций. Хотя в клетках они работают совместно с белками, в экспериментах были получены рибозимы, которые прочно и избирательно связывали НАД и с его помощью окисляли спирт в альдегид (рис. 10.4), – в клетках эту реакцию проводит НАД-содержащий белковый фермент алкоголь-дегидрогеназа (Tsukiji et al., 2004). Для никотинамида, ключевого компонента НАД, обнаружен простой путь синтеза, не требующий никаких ферментов и вполне реальный в условиях древней Земли. В нем простой сахар (диоксиацетон-фосфат) реагирует с аспарагиновой кислотой (одна из обычных аминокислот в составе белков) в водном растворе при температуре 60–100 °C (Cleaves, Miller, 2001). РНК, в которых на 5' конце находится НАД вместо обычного нуклеотида, обнаружены и в современных клетках: у кишечной палочки такой модификации подвергается до 15 % малых регуляторных РНК (sRNA) (Cahova et al., 2014), хотя функция НАД в составе этих РНК пока неизвестна. 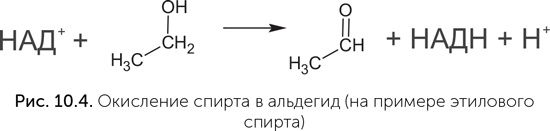
Кофермент А тоже прекрасно ладит с рибозимами. Очень впечатляет работа Вазанта Ядхава и Михаэля Яруса (Jadhav и Yarus, 2002). Они создали набор рибозимов, проводящих в одном опыте три последовательные химические реакции: пришивание КoA к концу РНК, активацию органической кислоты при помощи АТФ (при этом получается ацил-аденилат) и перенос кислотного остатка ацил-аденилата на КoA в составе рибозима. Затем другая команда химиков получила рибозим, который использует ацетил-КоА и малонил-КоА для реакции конденсации Клайзена (Ryu et al., 2006). В этой реакции – а она является ключевым шагом в построении длинных молекул жирных кислот – соединяются два остатка органических кислот. Еще один кофермент, который удалось заставить работать вместе с рибозимом, – это тиаминпирофосфат, активная форма витамина В1. Он используется в обмене веществ там, где надо присоединить или отщепить молекулу углекислого газа. Канадские химики Пол Чернак и Дипанкар Сен получили рибозим, который прочно связывает тиаминпирофосфат и с его помощью отщепляет СО2 от пировиноградной кислоты и ее аналогов (Cernak, Sen, 2013). Эта реакция очень важна в обмене веществ, через нее проходит «сгорание» всех потребляемых нами сахаров (подробнее в главе 11). Воспроизведение ее при помощи рибозима, а не белкового фермента – существенное доказательство возможности сложного обмена веществ до появления белков.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно