
|
||
|
|
||
|
|
Онлайн книга - Сумма биотехнологии. Руководство по борьбе с мифами о генетической модификации растений, животных и людей | Автор книги - Александр Панчин
Cтраница 47

А вот аминокислотная последовательность белка, который кодирует этот ген. 
Все последовательности находятся в свободном доступе, и любой специалист знает, где их найти. Обычный тест на наличие вставки в геноме организма заключается в поиске ее нуклеотидной последовательности в образце. Самый простой способ называется полимеразная цепная реакция (ПЦР). Его часто представляют как точный и надежный подход для обнаружения трансгенных вставок [247]. Существуют и другие, но метод ПЦР в его различных вариациях — самый дешевый, широко используемый и признан большинством регулирующих организаций. ПЦР — один из важнейших многофункциональных инструментов в руках биотехнолога. Он был разработан в 1984–1986 годах американским биохимиком Кэри Муллисом [248] и принес своему изобретателю Нобелевскую премию. ПЦР позволяет в считанные часы размножить одну-единственную молекулу ДНК определенной последовательности до миллиарда копий. Эта реакция стала возможной благодаря открытию бактерий, живущих в горячих источниках. ДНК-полимераза человека может достраивать вторую цепочку ДНК при температуре тела около 36 градусов. А вот у термофильных бактерий в результате эволюции появились ДНК-полимеразы, работающие при более высоких температурах, например при 72 градусах, и не разрушающиеся даже при очень высоких температурах порядка 95 градусов. Для проведения ПЦР нам понадобится именно такая термофильная полимераза, а также три чайника. В принципе можно было бы обойтись и одним чайником, а на практике и вовсе использовать программируемые термостаты, но так нам будет проще описать процедуру. Для работы ДНК-полимеразы, кроме правильной температуры, необходимы следующие компоненты: выделенная из образца ДНК, предположительно содержащая фрагмент, который мы собираемся размножить, свободные нуклеотиды (а точнее дезоксинуклеозидтрифосфаты, но давайте не будем использовать точную терминологию), специальная буферная смесь, содержащая различные ионы, необходимые для работы фермента. Наконец, нужны особые затравки, праймеры, про которые придется сказать несколько слов отдельно. Вот наш ген Cry-токсина. Но на этот раз запишем его в виде двух комплементарных цепей молекулы ДНК, одну под другой. Точки отображают пропущенный фрагмент середины гена. 
В этой записи появились названия двух концов цепочки ДНК: 5’ и 3’. ДНК-полимераза умеет присоединять нуклеотиды только к 3’-концу строящейся цепочки молекулы ДНК. Кроме того, ДНК-полимераза не умеет синтезировать ДНК с нуля, ей нужна затравка (праймер), комплементарная 3’-концу уже имеющейся цепочки ДНК, которую предстоит удвоить. Полимераза начинает достраивать нужную цепь, прикрепляя нуклеотиды к 3’-концу праймера. В живых клетках праймеры состоят из РНК и синтезируются особой РНК-полимеразой (которой затравка не нужна). Но мы будем использовать ДНК-праймеры, которые синтезируют химически в лаборатории, путем последовательного присоединения нуклеотидов друг к другу. Праймеры подбираются таким образом, чтобы между ними находился анализируемый нами ген или его фрагмент. Нам понадобятся два типа праймеров, изображенные ниже (стрелки показывают направления достраивания цепочек ДНК). 
Один праймер комплементарен 3’-концу левой части анализируемого фрагмента, а второй праймер комплементарен З’-концу его правой части. Концентрация праймеров должна быть высокой, зато исходного умножаемого фрагмента ДНК может быть хоть одна-единственная молекула. Смешаем все вышеупомянутые компоненты вместе с праймерами и ДНК-полимеразой из термофильной бактерии в пробирке и вернемся к нашим трем чайникам. В первом чайнике мы будем поддерживать температуру порядка 95 градусов. При такой температуре молекула ДНК денатурирует: превращается из двухцепочечной молекулы в две одноцепочечные. Поместим туда нашу пробирку. 
Во втором чайнике температура будет 58 градусов. Это оптимальная температура для специфичного присоединения наших праймеров, поэтому, когда мы поместим туда нашу пробирку со смесью, праймеры прилипнут к ДНК по принципу комплементарности. 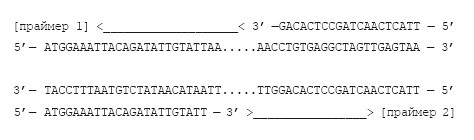
В третьем чайнике у нас будет температура 72 градуса, идеальная для работы ДНК-полимеразы термофильных бактерий. Когда мы поместим нашу пробирку туда, полимераза достроит молекулу ДНК до двойной цепочки. 
Была одна двухцепочечная молекула, а стало две. После этого мы снова помещаем пробирку в чайник при температуре 95 градусов, и цикл повторяется. Один цикл может занимать всего несколько минут, за час можно повторить все около двадцати раз, то есть увеличить концентрацию исходной молекулы в миллион раз. С обычной полимеразой, работающей при температуре 30–40 градусов, такая процедура не прошла бы по двум причинам. Во-первых, сама полимераза оказалась бы разрушена при высокой температуре, необходимой для разделения цепочек ДНК. Нам бы пришлось каждый раз добавлять полимеразу в реакционную смесь заново. Во-вторых, при низкой температуре праймеры будут прилипать не только к той цепи ДНК, с которой они полностью комплементарны, но и к похожим фрагментам, а значит, мы рискуем умножить не ту последовательность ДНК, которую хотели. Специфичность метода была бы намного ниже.
|

 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно