
|
||
|
|
||
|
|
Онлайн книга - Как победить свой возраст? 8 уникальных способов, которые помогут достичь долголетия | Автор книги - Алексей Москалев
Cтраница 18

Таблица 4. Уровень метаболитов крови, характеризующий 80-летних (по Т. Ванг, 2014) 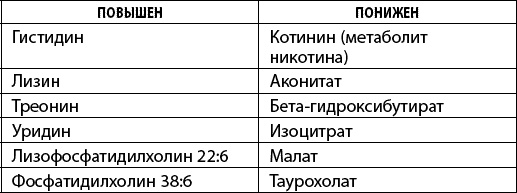
Совокупность жиров (называемая липидόм) давно привлекает внимание в связи с возрастом и долголетием. Относительно давно установлено, что при старении в некоторых случаях в крови увеличивается концентрация общего холестерина и свободных жирных кислот. Протеомика
Протеомика циркулирующих в крови белков также представляет большой интерес. Среди белков плазмы крови много потенциальных биомаркеров скорости старения (табл. 5). Таблица 5. Протеомные маркеры ускоренного старения в плазме крови 
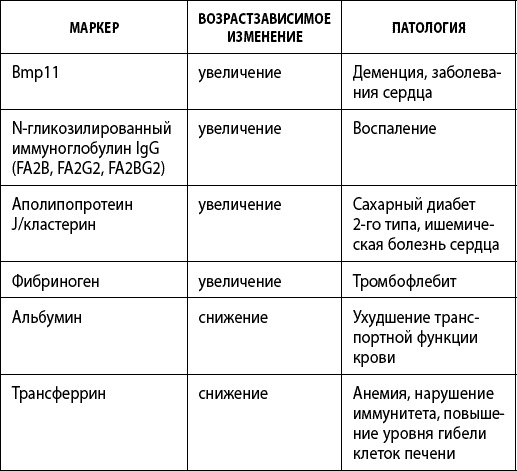
Липиды транспортируются в крови в комплексе с особыми белками-переносчиками. С точки зрения долголетия важно преобладание липопротеинов высокой плотности над липопротеинами низкой плотности и отсутствие избытков еще одного липида – холестерина. Повреждение глюкозой (гликирование) белка ApoB100 в составе липопротеинов низкой плотности ведет к потере его способности взаимодействовать с тканевыми рецепторами, обеспечивающими доставку жиров в клетки тела. Поврежденный ApoB100 начинает восприниматься организмом как чужеродный, вызывающий иммунный ответ. Липопротеины низкой плотности из-за меньших размеров легче проникают в стенку сосуда, где благодаря измененному ApoB100 атакуются иммунными клетками (макрофагами) и фагоцитируются (поглощаются и разрушаются ими). Макрофаги, скопившие много холестерина, превращаются в пенистые клетки, которые погибают, в результате чего кристаллы холестерина откладываются внутри стенки сосудов. Просвет сосуда сужается, он становится более хрупким, и кровоснабжение органов и тканей ухудшается. Неферментативное гликозилирование (гликирование) является распространенным механизмом повреждения белков в живом организме. Оно происходит в результате химической реакции (реакции Майяра) между глюкозой и аминогруппами в составе белков. Те же самые процессы, только в ускоренном темпе, происходят при образовании золотистой корочки при поджаривании мяса. Очень медленно стенки наших сосудов «поджариваются», разнося по тканям теплую кровь, насыщенную глюкозой и другими сахарами. В процессе старения происходит заметное накопление долгоживущих белков, подвергшихся гликированию, таких как коллагены, эластин (в стенке сосудов) и хрящевые белки (в суставах). Гликированные белки склонны к перекрестным сшивкам с образованием так называемых конечных продуктов гликирования (КПГ). Перекрестные сшивки между белками стенки сосуда снижают его эластичность и изменяют проницаемость сосуда для метаболитов. КПГ к тому же взаимодействуют с особыми рецепторами на поверхности клеток, вызывая воспалительные реакции. КПГ участвуют в возникновении многочисленных возрастных заболеваний, например, нейродегенеративных, сердечно-сосудистых и почечных. Конечные продукты гликирования можно измерить в плазме крови или даже на поверхности кожи с помощью флуоресцентной спектроскопии. Кроме того, применяют иммунологический анализ на карбоксиметиллизин, пентозидин, аргпиримидин, имидазолон. Уровень гликирования белков может быть оценен по количеству гликированного гемоглобина (HbA1c). Существенное превышение нормы по данному показателю может быть следствием развития сахарного диабета. Настольный прибор AGE Reader измеряет накопление в ткани КПГ с помощью флуоресцентных методов – измерения аутофлуоресценции кожи в определенном диапазоне длин волн. N-гликозилирование – это присоединение молекулы разветвленной цепочки сахаров (гликана) к белку с помощью специализированных ферментов. В результате образуется гликопротеин – молекула, состоящая из углевода и белка. Эта модификация позволяет белкам содействовать работе иммунной системы, участвовать в распознавании «свой – чужой». Гликаны часто производятся иммунной системой в ответ на заболевание. Не нужно путать N-гликозилирование с уже известным нам гликированием – спонтанным взаимодействием сахара и какого-либо белка, в результате которого белок повреждается и его функция теряется. При старении меняется спектр сахарных цепочек, присоединенных к белкам при N-гликозилировании. Это изменение является одной из причин хронических воспалительных процессов. Г. Лаук и коллеги показали, что уровень гликозилированных антител IgG в крови коррелирует с возрастом человека даже в большей степени, чем укорочение теломер, и может эффективно применяться для расчета биологического возраста человека. Профессор университета Болоньи К. Франчески на основании данных европейского исследования биомаркеров старения MARK-AGE (2008–2013 гг.) разработал тест на биологический возраст GlycoAgeTest, учитывающий логарифм соотношения количеств определенных гликанов – NGA2F, уровень которых с возрастом увеличивается, и NA2F, которых с возрастом становится все меньше. Чем больше значение критерия GlycoAgeTest, тем старше человек с биологической точки зрения. Еще один гликопротеин, количество которого зависит от возраста, – аполипопротеин J (кластерин). Пространственная укладка полипептидной цепочки любого белка играет определяющую роль в выполнении им своей функции. Кластерин помогает другим белкам сохранить правильную укладку, стабилизирует ее. Поскольку в процессе старения скапливаются денатурированные белки, нарастает и количество кластерина. Таким образом, он оказался ценным биомаркером старения. Его уровень повышен у пациентов с сахарным диабетом типа 2, ишемической болезнью сердца, инфарктом миокарда. Его уровень можно измерять в сыворотке крови. Давно известно, что при старении постмитотических тканей, таких как скелетная мускулатура, сердечная мышца, головной мозг, в больших количествах накапливаются агрегаты окисленных белков. Окисление белковой молекулы приводит к утрате поверхностного заряда и растворимости белка в воде. Нерастворимые белки начинают образовывать фибриллы и бляшки, так называемый амилоид. Наиболее известными формами старческого амилоидоза является болезнь Альцгеймера, а также амилоидоз сердца и почек. Увеличение доли окисленных белков при старении связано с накоплением дефектных митохондрий, в избытке выделяющих свободные радикалы, с подавлением процессов репарации и деградации поврежденных белков. Поэтому показателями скорости старения являются как снижение активности механизмов деградации – аутофагии (внутриклеточного переваривания поврежденных структур) и протеасомы (расщепления ненужных белков до аминокислот), так и репарации окисленных белков через систему метионин сульфоксидредуктазы. Данные изменения в качестве биомаркеров старения удобно наблюдать в мононуклеарных клетках периферической крови.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно