
|
||
|
|
||
|
|
Онлайн книга - Лаборатория химических историй. От электрона до молекулярных машин | Автор книги - Михаил Левицкий
Cтраница 47

Сравните эту ситуацию с органической химией, где на сегодня описано свыше 100 млн соединений! Запомнить подобное количество тривиальных названий практически невозможно, поэтому используют названия, составленные по строгим правилам номенклатуры. Вот пример названия: 2-(tert-butyl)-5-(furan-2-yl)-N-nonylaniline. Предполагается, что грамотный химик-органик сумеет правильно написать по нему структурную формулу. Однако это могут сделать не многие. К счастью, были созданы специальные программы: на рис. 7.11 показана структурная формула, которую вывел компьютер по указанному выше названию. 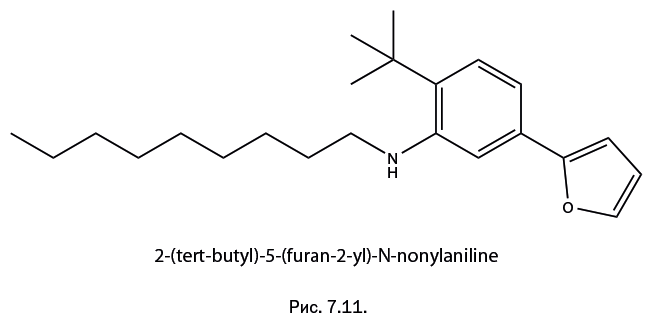
Возможно и обратное решение задачи: по нарисованной структуре (при условии, что она изображена грамотно) программа может составить название в соответствии с правилами номенклатуры. В отличие от химиков-органиков, геохимики обходятся обычными брутто-формулами, отражающими только состав, а расположение атомов обозначают специальным термином, указывающим на тип кристаллической структуры. Вернемся к аналогиям между металлосилоксанами и металлосиликатами. Вначале мы рассмотрим силикатные минералы, содержащие только переходные металлы. Это весьма скромная группа минералов: тефроит Mn2[SiO4], родонит Mn2[Si2O6], фаялит Fe2[SiO4], ферросилит Fe2[Si2O6], кнебелит (Fe, Mn)2[SiO4], хризоколла Cu8[Si4O10]2(OH)12 ⋅ nH2O и циркон Zr[SiO4], причем их запасы крайне невелики. Итак, несмотря на то, что металлосиликатов громадное количество, соединений, которые содержат только переходные металлы, очень мало. Cразу возникают естественные вопросы: где же сосредоточены переходные металлы и из чего их добывают для нужд индустрии? Оказалось, что это оксиды: Fe2O3 – гематит, MnO2 – пиролюзит, Cu2O – куприт, CuO – тенорит, TiO2 – рутил, ZrO2 – бадделеит, а также крупная группа минералов, представляющих собой смешанные оксиды, называемые шпинелями: FeIIIFeII2O4 – (магнетит), Cr2FeO4, MnFe2O4, Fe2TiO4, NiFe2O4. Существует несколько десятков шпинелей, содержащих переходные металлы, причем запасы этих минералов достаточно велики. Например, в земной коре содержатся триллионы тонн магнетита, что на несколько порядков больше силиката железа. Справедливости ради отметим, что большие количества переходных металлов сосредоточены также в сульфидах, но мы их здесь не рассматриваем. Можно предположить, что основная масса силикатов переходных металлов, оказавшись в благоприятных "с точки зрения" реакции перегруппировки условиях, постепенно распадалась с образованием вышеперечисленных оксидов. Те немногочисленные вышеупомянутые силикаты переходных металлов, которые присутствуют в земной коре, вероятнее всего, оказались в условиях пониженной температуры в результате геологических процессов, сопровождавшихся перемещением горных масс, что привело к резкому торможению перегруппировки. Результаты геохимических процессов в земной коре указывают на заметное сходство с закономерностями, найденными для металлосилоксанов. Удачно дополняет эти наблюдения состав речного песка, имеющего светло-желтый цвет. Диоксид кремния SiO2 содержит 9–12 % оксида железа Fe2O3, который придает песку желтый цвет. Возникает естественный вопрос: почему оксид железа оказался вплавленным в диоксид кремния? Почему не прореагировали эти два оксида, один из которых (SiO2) имеет кислотный характер, а второй (Fe2O3) – основной характер? Напомним, что силикаты железа в принципе существуют и реально присутствуют в земной коре в виде конкретных соединений. Эти наблюдения позволяют предположить, что во многих случаях переходные металлы не удержались в силикатной матрице и образовали оксиды, что напоминает реакции, показанные на рис. 7.3. Естественно, геохимики не могли не заметить такие процессы, причем обратили на них внимание достаточно давно. Еще в начале XX столетия геохимик академик В. И. Вернадский писал: "…здесь (в глубинных слоях литосферы) мы встречаемся с перегруппировкой химических соединений, идущей в твердой среде…" [11] Невольно хочется подчеркнуть в цитате термин «перегруппировка», неоднократно упоминавшийся ранее при обсуждении элементоорганических работ. Вернадский специально обращает внимание на процессы образования кварца (это все тот же SiO2) из сложных соединений: "…мы наблюдаем больше процессов, ведущих к его (кварца) образованию, чем к его исчезновению, переходу в другие типы соединений" [12]. Разделение силикатов металлов на составляющие оксиды могло протекать не только в расплавленной магме, но в твердой фазе при высоких температуре и давлении. И несомненно, оно было достаточно длительным, в течение тысячелетий. Мы рассмотрели процессы, движущей силой которых является координационная ненасыщенность иона металла в силоксановой матрице. Результаты, полученные методами элементоорганической химии, позволяют ответить на вопрос "Когда тормозится перегруппировка?". По составу минералов земной коры можно установить, что существует большая группа силикатов, содержащих переходные металлы, и в них непременно входит ион щелочного металла. Эти крупные классы минералов достаточно многочисленны, и мы, не приводя точный их состав, укажем только сочетание ионов щелочных и переходных металлов: биотиты (K, Fe), пироксены (Na, Fe), амфиболы (K, Na, Fe, Mn, Ti). Такие минералы в большинстве своем весьма распространены, и своим существованием они подтверждают вторую закономерность химии металлосилоксанов – стабилизацию координационной сферы переходного металла силанолят-анионом, который возникает в присутствии щелочного металла. Об этом мы уже сказали при обсуждении металлосилоксанов. Кроме того, существует еще одна очень крупная группа минералов, в которых одновременно присутствует ион переходного металла и щелочноземельного металла (или магния). Не приводя точный состав, укажем лишь сочетание переходных и щелочноземельных металлов (и магния): оливины (Mg, Са, Fe. Mn), гранаты (Mg, Ca, Fe, Mn, Cr, V), шамозиты (Fe, Mg), гарниериты (Ni, Mg). Это весьма распространенные минералы, образующие залежи большой мощности. Состав таких минералов согласуется с рассмотренной нами ранее второй закономерностью химии металлосилоксанов – стабилизацией силанолят-анионами, поставляемыми в систему щелочноземельными металлами. "Участие" магния в указанном процессе вполне объяснимо – электроотрицательности Na, Ca и Mg довольно близки (0,9; 1,0; 1,2 соответственно). Подводя итог, отметим, что закономерности перегруппировки металлосилоксанов выходит за рамки элементоорганической химии и могут быть применены к описанию некоторых геохимических процессов и особенностей формирования определенных минералов. Рассмотренная нами перегруппировка металлосилоксанов уникальна тем, что помогает понять, как и почему происходят эти превращения. Кроме того, она позволяет моделировать процессы, которые происходили в земной коре в течение длительного времени. Такие превращения можно проводить гомогенно в среде органических растворителей с большой скоростью – иными словами, спрессовывая тысячелетия в минуты.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно