
|
||
|
|
||
|
|
Онлайн книга - Лаборатория химических историй. От электрона до молекулярных машин | Автор книги - Михаил Левицкий
Cтраница 46

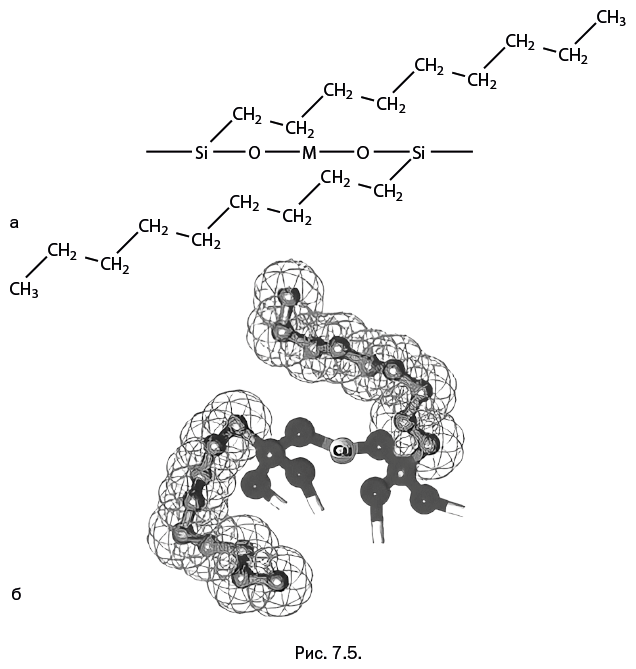
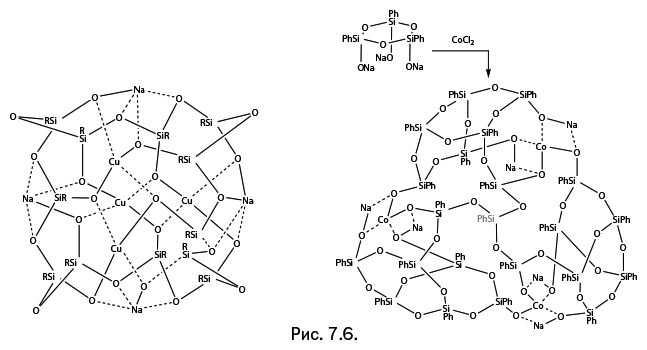
Кроме того, ион поливалентного металла для заполнения своей координационной сферы может выбирать еще один, не упомянутый ранее атом кислорода – он находится в силанолятной группе RSi-O-Na. В присутствии такой группы соединение наиболее устойчиво к перегруппировке. Примеры соединений показаны на рис. 7.6: молекулы напоминают деформированную глобулу и трехлопастной винт. Координирующие свойства атома кислорода в силанолятной группе RSi-O-Na столь высоки, что он способен вытеснять из координационной сферы металла даже "классический" для химии металлосилоксанов атом кислорода во фрагменте Si – O – M. Например, молекулы железосодержащего силоксана (рис. 7.7а) объединяются в димеры таким образом, что в координационной сфере железа оказывается четыре атома О (рис. 7.7б). Но если подействовать на димер силанолятом натрия Me3Si-O-Na, то димер распадается, а атом железа вновь дополняет свою координационную сферу до четырех атомов О, но теперь уже с наиболее предпочтительным атомом О из силанолятной группы (рис. 7.7в). 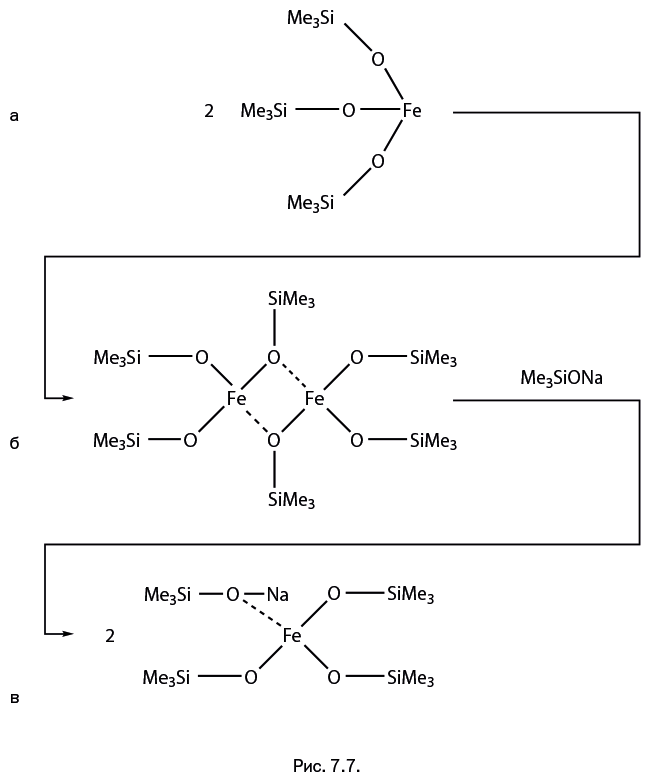
В силанолятной группе RSi-O-M' может находиться ион не только щелочного, но и щелочноземельного металла – например, кальция. В таком случае перегруппировка тоже блокируется. Пример подобного соединения показан на рис. 7.8. Это вновь шестигранная призма, напоминающая барабан. Между прочим, изображение структурной формулы с показанными пунктиром координационными связями удобно тем, что позволяет визуально оценить правильность написания формулы, поскольку число сплошных валентных линий, подходящих к символу элемента (пунктирные линии не учитываются), указывает степень окисления. В результате можно убедиться, что медь, кальций и кислород двухвалентны, а кремний – четырехвалентен, четвертая палочка подразумевается между Si и Ph. 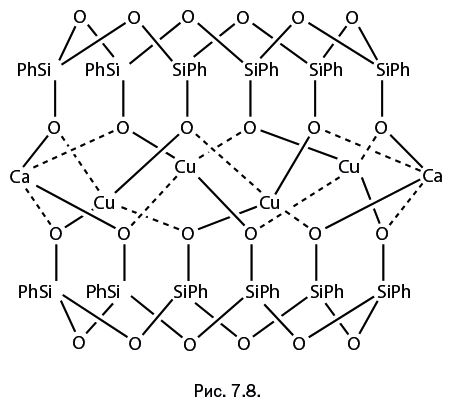
Более сложные каркасные конструкции представить в таком виде иногда довольно трудно. Это, конечно, возможно, но рисунок получится слишком сложным. Торможение перегруппировки в присутствии щелочных и щелочноземельных металлов вполне объяснимо. Они обладают крайне низкой электроотрицательностью – иными словами, исключительно охотно отдают валентные электроны соседнему атому О, а тот, в свою очередь, с легкостью использует их для образования координационной связи с металлом. Это может напомнить цепочку добрых дел, которые люди последовательно совершают друг для друга. Из всего описанного можно сделать два вывода: 1. Наиболее склонны к глубокой перегруппировке, протекающей вплоть до образования оксида металла, переходные металлы – например, Cr, Mn, Fe, Co, Ni, Cu и др. 2. Эффективно тормозит перегруппировку присутствие в структуре, наряду с переходными металлами, щелочных или щелочноземельных металлов. К этим выводам мы вернемся при обсуждении следующего раздела этой главы. Рассмотрим примеры ускорения перегруппировки. Наиболее отчетливо она протекает в аморфных (не кристаллических) металлосилоксанах, что вполне понятно, поскольку при образовании кристаллической структуры координационная сфера металла заполняется оптимальным образом. Через несколько минут после добавления в раствор железосилоксана незначительного количества катализатора – хлорида железа FeCl3 – выпадает осадок, обогащенный железом. Его атомное отношение Fe: Si = 5:1. Не успевает образоваться чистый оксид железа, не содержащий кремния, поскольку соединение выпадает в осадок, а в твердой фазе реакция резко тормозится. Приведем другой пример быстрого протекания перегруппировки. При нагревании аморфного светло-голубого медьдиметилсилоксана до 90 оС порошок резко темнеет и покрывается прозрачной бесцветной маслянистой жидкостью. Темно-коричневый порошок – это оксид меди CuO, а маслянистая жидкость – циклосилоксан [Me2SiO]4 (рис. 7.9). 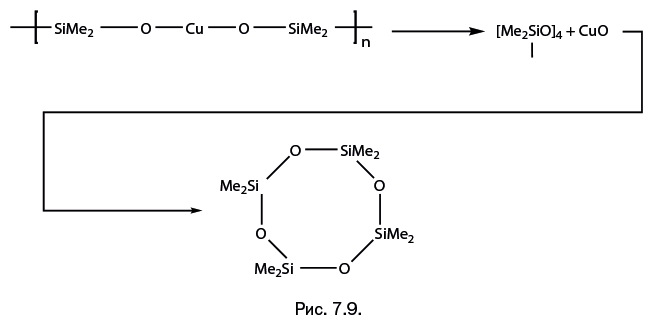
Следовательно, перегруппировку, протекающую в течение нескольких минут, можно наблюдать визуально. Однако в некоторых случаях эта реакция протекает в течение тысячелетий, о чем будет рассказано в следующем разделе. От металлосилоксанов к земной коре
После детального изучения перегруппировки возник вопрос, до какой степени являются общими найденные закономерности и насколько они применимы к соединениям близкого состава. Обратите внимание на то, что металлосилоксаны представляют собой, по существу, неорганические металлосиликаты, окруженные органическими группами. Вполне естественно было предположить, что закономерности, выявленные для металлосилоксанов, в определенной степени будут воспроизводиться на их неорганических аналогах. Невозможно повторить все описанные выше исследования с металлосиликатами, так как они нерастворимы, однако сама природа позволила нам провести сопоставление – ведь именно металлосиликаты составляют свыше 50 % массы земной коры. Земная кора состоит из застывших пород, имеет переменную толщину и на сегодня достаточно подробно изучена (рис. 7.10). 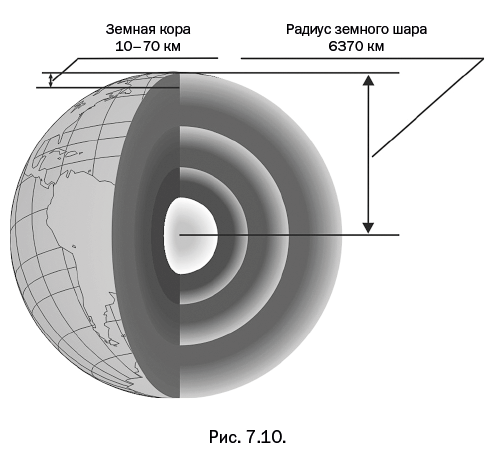
Минералы земной коры изучает геохимия, и можно сказать, что геохимикам в определенной степени повезло: состав 95 % земной коры описывается приблизительно двумя тысячами природных минералов, что сравнительно немного. Для них используют специальные короткие тривиальные (то есть упрощенные) названия, указывающие на местность, где они были найдены: например, ильменит FeO·TiO2 (найден в Ильменских горах) – или на фамилию ученого (Fe, Mn)(WO4) – ферберит (по имени немецкого минералога М. Р. Фербера); СuO – тенорит (предположительно, по имени итальянского ботаника М. Теноре). Иногда название содержит упоминание состава: молибдит – MoO3. Такие названия легко запоминаются, а грамотный геохимик сумеет «прочитать» в нем и состав, и особенности кристаллической структуры.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно