
|
||
|
|
||
|
|
Онлайн книга - Лаборатория химических историй. От электрона до молекулярных машин | Автор книги - Михаил Левицкий
Cтраница 12

Известная забава
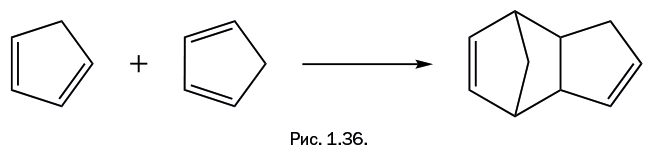
В органической химии существует реакция, имеющая сразу два названия: «диеновый синтез» и «реакция Дильса – Альдера», и обычно используют либо первое, либо второе название. Участвуют два реагента: соединение с двойной связью (олефин) и соединение с двумя двойными связями, разделенными одной одинарной (сопряженный диен). Олефин Х – СН=СН – Х обычно содержит дополнительные группы Х (Х – карбонильная, карбоксильная, нитрогруппа и др.), которые активируют двойную связь олефина, что облегчает протекание синтеза. Все три двойные связи в реагентах раскрываются с последующим замыканием и образованием новых связей (рис. 1.35). Таким образом, в исходной системе – три двойные связи, а в результате образуется циклическое соединение с одной двойной связью. Поскольку в процессе происходит только перегруппировка связей, то побочные продукты не образуются. За открытие этой реакции немецкие химики О. Дильс и К. Альдер в 1950 г. были удостоены Нобелевской премии. Диеновый синтез широко применяют при синтезе лекарств, витаминов и других продуктов. "Герой" нашего рассказа – циклопентадиен – способен проводить диеновый синтез "сам с собой", причем просто при хранении, и никакие дополнительные группы Х не требуются. Одна молекула участвует как диен, а вторая "изображает" олефин, то есть участвует только одной двойной связью (рис. 1.36). В полученной молекуле нет сопряженных двойных связей, то есть расположенных через одну простую связь по типу: -С=С-С=С-. Следовательно, оно не может далее участвовать в диеновом синтезе. 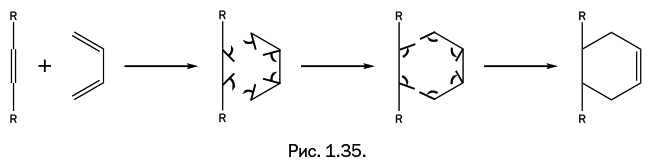
Тем не менее с участием циклопентадиена удалось реализовать эффектный вариант диенового синтеза. В качестве исходного было взято соединение, содержащее два циклопентадиенильных кольца, связанных гибкой углеводородной перемычкой -(СН2)n– (рис. 1.37а). Второй компонент, как и на рис. 1.35, – олефин, активированный группами Х. Одно из циклопентадиенильных колец, играя роль диенового компонента, реагирует с олефином строго по схеме диенового синтеза (рис. 1.37б). В верхнем циклическом фрагменте образовавшейся молекулы появилась «одинокая» кратная связь. Следовательно, теперь это уже олефиновый компонент: в нижней части имеется не затронутый пока диеновый компонент – циклопентадиенильное кольцо. Все эти двойные связи также могут реагировать далее по схеме диенового синтеза (рис. 1.37в). Вновь образующиеся связи на двух стадиях показаны утолщенными. 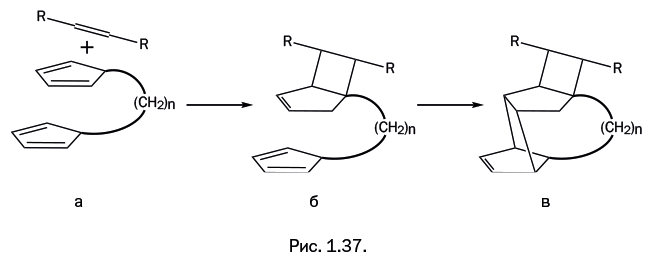
Реакция, прошедшая в одной части молекулы, может протекать и в другой части, и вся цепочка реакций повторится. Реагирующие кратные связи перемещаются по молекуле: такая реакция получила название «домино», поскольку напоминает ситуацию, когда одна падающая кость вызывает падение соседней. Превращения типа «домино» в органической химии представляют собой особый класс реакций: осуществляется целый каскад перегруппировок без введения дополнительных реагентов. Однако рассмотренная изящная реакция до поры до времени не использовалась и оставалась лишь элегантной историей для профессиональных химиков. «Частичка» алмаза
В 1933 г. чешские химики С. Ланда и В. Махачек выделили из нефти с Годонинского месторождения (которое расположено в Моравии) соединение с составом C10H16. На основании результатов элементного анализа и необычайно высокой температуры плавления – 268 оС – они практически угадали строение соединения. Позже предположение было подтверждено структурными исследованиями. Это великолепный пример эрудиции и интуиции химиков, способных безошибочно определить строение соединения при минимуме данных. Авторы назвали новое соединение адамантан (греч. ἀδάμας – «алмаз»). Он представляет собой насыщенный углеводород, его каркасная молекула исключительно симметрична и по-своему привлекательна. Атомы углерода расположены в адамантане так же, как в кристаллической структуре алмаза, что и определило название. Адамантан присутствует в нефти в количестве не более 0,03 %, следовательно, для детального изучения его необходимо синтезировать. В 1941 г. швейцарскому химику В. Прелогу (получившему в 1975 г. Нобелевскую премию за изучение стереохимии органических соединений) удалось получить адамантан. Это стало возможным в результате пятистадийного синтеза, однако с очень низким выходом – менее 1 %. Естественно, подобный способ получения не устраивал химиков, заинтересовавшихся соединением и желающих исследовать его подробнее. 
Химики обратили внимание на определенное сочетание свойств соединения: каркас адамантана – жесткий, но ненапряженный, все углы между атомами углерода – 109,5о – такие же, как в насыщенных углеводородах. Соединение химически очень устойчиво, не реагирует с кислотами и щелочами и имеет высокую температуру плавления. Все указывает на то, что соединение энергетически выгодно, то есть в подходящих условиях должно образовываться легко и самопроизвольно. И вот наступает момент, когда на сцену выходит "герой" нашего рассказа циклопентадиен, который, как сказано выше, легко димеризуется при хранении, образуя полициклическое соединение. Таким образом, этот димер даже не требуется специально получать (на рис. 1.39 показан тот же самый димер, что и на рис. 1.36, только не в плоском, а в объемном варианте). 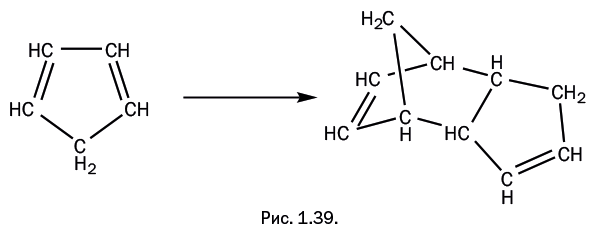
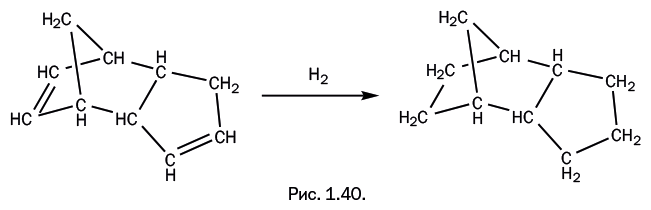
Димер гидрируют, двойные связи становятся одинарными, в итоге получается насыщенное соединение (без кратных связей), имеющее состав С10Н16 – то есть точно такой же, как у адамантана (рис. 1.40).
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно