
|
||
|
|
||
|
|
Онлайн книга - Обоняние. Увлекательное погружение в науку о запахах | Автор книги - Паоло Пелоси
Cтраница 45

Разрешение структуры белка Определение трехмерной структуры белка – непростая задача даже сегодня, а для некоторых классов белков прямо-таки откровенно сложная. Ни в какой, даже самый мощный, микроскоп невозможно разглядеть форму молекулы белка. Первое, и самое главное ограничение, с которым приходится иметь дело, – длина волны света, с которым мы работаем. Видимый свет охватывает длину волн приблизительно от 400 до 800 нм (где нм – нанометр, одна миллионная миллиметра). Любой объект размером меньше 200 нанометров будет выглядеть размыто, и идентифицировать его никак не получится. Типичный белок от маленького до среднего размера можно себе представить как шарик диаметром примерно 3 нм – это в сто раз меньше лимита, устанавливаемого светом. При помощи направленного пучка электронов можно продвинуться значительно дальше; электронные микроскопы уже подарили нам изображения крупных сегментов ДНК и даже отдельных белков, которые, правда, все равно выглядят как размытые точки. Разглядеть расположение атомов в них нет никакой возможности – для этого нужно еще более высокое разрешение. Один атом, условно упрощенный до шарика, имел бы диаметр 0,1–0,2 нм: именно такое разрешение понадобилось бы, чтобы разглядеть внутреннюю структуру белка. Но, вместо того чтобы наблюдать атомы напрямую, мы можем вычислить их позиции по дифракционной картине, которую дают рентгеновские лучи, взаимодействуя с кристаллом белка. Объяснить этот метод не так-то легко, да и на практике он не слишком прямолинеен. Прежде всего нужно вырастить кристалл белка – эта задача подразумевает много попыток, ни одна из которых не гарантирует успеха. Далее: от кристалла нужно получить хорошую дифракционную картину, а затем еще и интерпретировать полученные данные в свете пространственной системы координат. Разумеется, при этом приходится надеяться, что структура кристаллического белка повторяет его естественную укладку, когда он свободно плавает в растворе. Это допущение кажется натянутым и не слишком реалистичным, но на самом деле оно совершенно разумно и может быть принято достаточно уверенно. Дело в том, что кристаллы белков сильно отличаются от тех, с которыми мы сталкиваемся в повседневной жизни – кварца, сахара или поваренной соли. Когда молекулы белка организуются в упорядоченную матрицу из строчек и столбиков, они берут с собой много воды и сохраняют таким образом прежнее окружение, которое было в растворе. Кристалл белка, в отличие от твердого кристалла сахара или кварца, очень хрупок и разбивается нередко даже при очень осторожном обращении. Все утонченные технологии, помогающие завершить структуру белка, нас сейчас не интересуют, поэтому давайте сосредоточимся на результате процесса и на том, как он отражается на функциях белков. Поскольку получить трехмерную структуру белка очень сложно, имеет смысл спросить, нельзя ли что-то извлечь из последовательности аминокислот. Окончательная форма белка, как мы уже говорили, во многом закодирована в его последовательности; в большинстве случаев белок складывается в растворе так, как сложился бы в самой стабильной ситуации, спонтанно и в подходящей среде (pH, соли, лиганды и т. д.). Поэтому хотя бы в теории должна быть возможность рассчитать складывание белка, опираясь на его секвенцию. Но это и правда очень трудная задача. Впрочем, учитывая, сколько всего мы сейчас знаем о структуре многих белков, принадлежащих к самым разным семействам, можно сделать проще – а именно предположить, что белки с похожими секвенциями могут быть похожи и структурно. Поэтому, если в наличии есть данные о последовательности, их попросту скармливают компьютеру, который ищет похожие белки в огромной базе. Обнаружив что-то похожее, чьей структурой или физиологическими функциями наука уже когда-то интересовалась, мы можем пролить свет и на наш новый белок. Структура первого ОСБ Именно это мы и проделали с коровьим ОСБ, как только получили хотя бы частичную информацию о его аминокислотной последовательности. Нам сразу же стало ясно, что этот ОСБ относится к куда более обширному семейству белков, у которых общие не только последовательность и трехмерная структура, но даже и некоторые функции. Кое-какие из этих белков уже изучались, а у парочки ученые даже разрешили трехмерную структуру – например, у ретиноло-связывающего белка (переносчика ретинола в крови) и у β-лактоглобулина, одного из основных компонентов молока. Впоследствии их стали звать липокалинами – из-за способности связывать гидрофобные соединения (липиды и другие молекулы) и чашеобразной формы (calyx). На дне такой чашечки располагается зона, где локализуется лиганд (в случае ОСБ – одорант), – это водоотталкивающая область, где гидрофобному лиганду будет достаточно уютно, в отличие от внешней водной среды. На следующем этапе нужно было добыть кристалл и разрешить подробную структуру коровьего ОСБ – первого члена семейства, который нам удалось изолировать. На это ушло несколько лет. Проблема заключалась не в кристаллизации белка, который как раз поддавался очень хорошо, производя довольно крупные кристаллы сравнительно малыми усилиями, а в интерпретации дифракционных данных. Белок относился к липокалинам и, по идее, должен был показать структуру, похожую на других его родственников, – но полученные данные этому решительно противоречили. 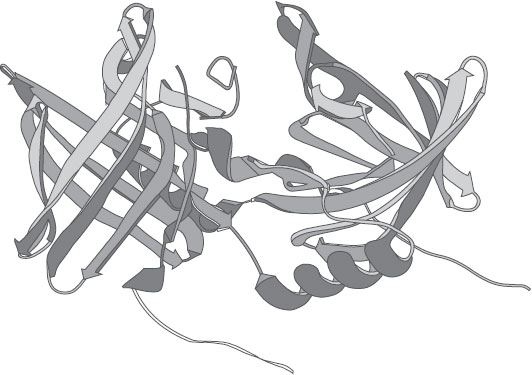
Рисунок 22. Трехмерная структура коровьего одоранто-связывающего белка. В отличие от большинства липокалинов, этот ОСБ демонстрирует довольно необычный феномен замены домена – когда спираль одного фрагмента взаимодействует с сердцевиной другого. Такие взаимные отношения двух суб-фрагментов обеспечивают димеру большую стабильность. Вскоре нам стало ясно, что, хотя сердцевина коровьего ОСБ имеет пресловутую классическую форму чашечки (или, если угодно, корзинки), сам белок отличается от остальных представителей семейства. Это был димер с двумя плотно сцепленными фрагментами, демонстрирующими так называемый феномен замены домена. Это означает, что один домен (сегмент, в особенности спираль) одного суб-фрагмента взаимодействует с сердцевиной другого и наоборот. Похоже на руку, которая высовывается наружу и хочет взять другой белок (см. рис. 22). Это стабилизирует структуру белка и превращает димер в очень своеобразную компактную молекулу. Разрешение структуры первого ОСБ, изолированного из коровьей назальной ткани, стало плодом усилий сразу двух групп: итальянской, под руководством Уго Монако (к которой принадлежал и я), и американской, которую возглавлял Марио Амцель, сотрудничавший с Соломоном Снайдером. Как видите, те же ученые, что в свое время соревновались, кто первым очистит ОСБ, сошлись вместе в одной статье, где структура в итоге и была опубликована. Иногда соревновательность стимулирует – особенно в самом начале исследовательского проекта; она помогает генерировать новые идеи и заставляет стремиться к завершению. Но на более поздних стадиях она может привести к напрасной трате фондов и сил и идет на пользу уже не науке, а только персональным амбициям. В подобных случаях всегда лучше превратить соревнование в сотрудничество – это сразу и эффективнее, и продуктивнее.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно