
|
||
|
|
||
|
|
Онлайн книга - Как изобрести все | Автор книги - Райан Норт
Cтраница 85

Изотоп с большим количеством нейтронов будет весить больше, чем изотоп с меньшим. Вокруг ядра вращаются отрицательно заряженные электроны, они двигаются по разным орбитам, одни находятся ближе, другие дальше. На самой маленькой орбите может находиться два электрона, на второй – 8, на третьей 18 и так далее, где количество электронов определяется формулой 2(n2), где n – номер орбиты, начиная от ядра. И хотя электроны имеют тенденцию держаться ближе к ядру, внутренние орбиты не всегда должны быть заполнены электронами прежде, чем начнут «заселяться» внешние. С учетом всего этого грубая модель атома может выглядеть следующим образом (рис. 49). 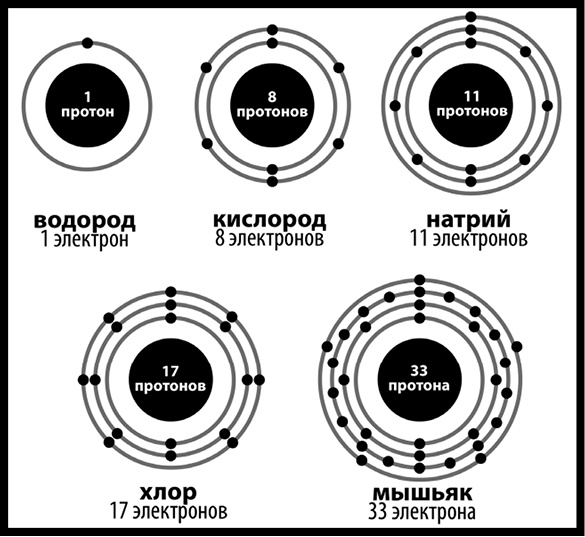
Рис. 49. Схематическое изображение нескольких элементов. Если вы ждали тут химическую шутку, то мы приносим наши извинения. Не в этот раз Атомы могут комбинироваться с другими атомами, формируя таким образом молекулы: именно это и есть химические реакции, о которых вы слышали ранее. Электроны, расположенные вокруг атома, могут дать вам намек на то, насколько активен тот или иной из них: атомы желают, чтобы их внешние орбиты были заполнены электронами, так что элементы, добившиеся такого состояния, будут куда менее охотно вступать в реакции, чем их собратья, имеющие свободные ячейки. И в общем все происходит так, как можно этого ждать: элементы с двумя дополнительными электронами имеют тенденцию вступать в реакцию с элементами, которым нужны два электрона для заполнения внешней орбиты. Это означает, что атомы, чья внешняя орбита (или оболочка) заполнена, – такие, как гелий или неон, – не будут вообще вступать в реакции. Гелий и неон столь пассивны, что долгое время считалось – их невозможно встретить в составе молекул. На самом деле подобные молекулы существуют, изготовить их не такое уж большое дело, но они обычно возникают при предельно высоком давлении и (или) предельно низкой температуре. Давайте посмотрим на воду как на пример химической реакции: два атома водорода и один атом кислорода могут образовать комбинацию, чтобы получилась вода, или Н2О (2 говорит, что у нас тут два атома водорода). У кислорода на внешней электронной оболочке имеется шесть заполненных слотов, а у атомов водорода по одному электрону, так что два атома водорода делятся электронами с одним атомом кислорода, формируя молекулу воды, и если можно сказать об атомах, что они «счастливы» [205], то тут они находятся именно в таком состоянии. Подобный дележ электронов называется ковалентной ат омной связью. Но есть другой аспект, который необходимо рассмотреть: электрический заряд. Электроны несут отрицательный заряд, протоны – положительный, и поскольку у большинства элементов число нейтронов и протонов совпадает, то эти заряды обнуляют друг друга и атомы оказываются электрически нейтральными. Тем не менее атомы не всегда делятся электронами, как это происходит в случае с водой. Иногда они могут обмениваться ими, и когда это происходит, то есть один из атомов теряет электроны, а другой их приобретает, в результате мы получаем два атома с разным по знаку зарядом. А противоположности (не только в химии, но и в романтических отношениях) притягиваются, в то время как подобия отталкивают друг друга. Пример этого: натрий (Na в периодической таблице) может похвастаться 11 электронами: 2 на первом уровне, 8 на втором и 1 на внешнем. Хлор (Cl) имеет 17 электронов, что значит 2 на первом, 8 на втором и 7 на внешнем. Хлору требуется 1 электрон, чтобы заполнить внешний уровень, а если натрий избавится от одного, то его внешний уровень тоже станет полным, так что обмен происходит. Но натрий, лишившись электрона, получает положительный заряд, а хлор, приобретая лишний, – отрицательный. Поэтому они притягивают друг друга и образуют соединение NaCl, или соль, а связь, возникшая благодаря электрическому притяжению, именуется ионной. Ковалентные связи распадаются с большей легкостью, сдача электронов в аренду – штука менее прочная, и потому такое имеет место чаще всего в веществах, жидких или газообразных при комнатной температуре. Ковалентные связи возможны только между неметаллами (металлы и неметаллы перечислены в таблице, и там же указаны полуметаллы, промежуточные элементы, обладающие свойствами той и другой группы). Ионные связи разорвать сложнее, и они чаще всего формируют нечто твердое при комнатной температуре, возникая обычно между металлом и неметаллом. И знаете что? Прочитав несколько последних абзацев, вы одолели всю дистанцию между 13 799 млн лет до н. э. и началом ХХ века н. э. (именно этому времени соответствует ваш нынешний уровень знаний). Нам потребовалось добраться до 1800 н. э., чтобы понять, чем именно являются элементы, так что какого черта, даже если вы бегло просмотрели эти абзацы, вы все равно невероятно хорошо справляетесь. Если пойти дальше, то протоны и электроны состоят из еще более мелких частиц (именуемых кварками, и те бывают шести разных шизанутых видов или «ароматов» [206]), а электроны не столько вращаются вокруг ядра, сколько «существуют как волны в не поддающемся наблюдению ареале потенциальных локаций, а не как точечные сгущения» [207]. Но подобный уровень детализации в ваших обстоятельствах вам не требуется, разве что вы соберетесь построить машину времени, а вы не соберетесь, поскольку создание машины времени – настолько сложный процесс, что нам проще написать руководство по тому, как создать цивилизацию с нуля, чем взяться за объяснение принципов конструирования машин времени. Существование атомов сложно доказать, если под рукой у вас нет исключительно сильных микроскопов, но вы можете наблюдать их в действии. Пылинка в стакане воды, например, движется случайным образом, и это «[вставь свое имя] движение» (а вовсе не «броуновское движение», по имени ботаника Роберта Броуна, открывшего феномен в 1827 н. э.) имеет место по той причине, что пылинку постоянно с разных сторон ударяют крохотные частички (то есть молекулы) воды.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно