
|
||
|
|
||
|
|
Онлайн книга - Загадки сна | Автор книги - Михаил Полуэктов
Cтраница 44

Довольно быстро выяснилось, что кроме желаемого противоаллергического действия блокаторы гистаминовых рецепторов вызывают целый ряд неприятных побочных эффектов – сонливость, сухость во рту, нарушение зрения, сердечную аритмию, снижение секреции желудочного сока. Последнее свойство связано с тем, что эти препараты блокируют другой тип гистаминовых рецепторов – H2, которые находятся в желудке и регулируют уровень секреции соляной кислоты. В дальнейшем для лечения язвенной болезни желудка были разработаны селективные блокаторы этих рецепторов. Другие побочные эффекты применения дифенилгидрамина, за исключением сонливости, оказались обусловлены блокирующим воздействием этого препарата не только на гистаминовые, но и на ацетилхолиновые рецепторы. При этом наблюдалось затруднение деятельности внутренних органов, управляемых парасимпатической частью нервной системы, переносчиком сигнала в которой служит ацетилхолин. При приеме этих препаратов развивались запоры, нарушался отток мочи и повышалось внутриглазное давление. С целью преодоления этих негативных эффектов в дальнейшем были разработаны селективные антигистаминные средства 2-го поколения, действующие только на периферические H1-рецепторы. Они не вызывают ни центральных, ни периферических нежелательных эффектов, поэтому для лечения аллергии применяют именно их. Примером такого препарата является антиаллергическое средство лоратадин (кларитин). Снотворное действие, вызванное «неселективным» дифенилгидрамином, стало спасением для некоторых больных инсомнией, поскольку этот препарат оказался доступным и дешевым. Было проведено множество клинических исследований, подтвердивших, что дифенилгидрамин действительно улучшает ночной сон при его нарушении, в том числе и у детей. Поэтому перед учеными встала задача: «отделить» центральный снотворный эффект антигистаминного средства от периферического противоаллергического эффекта и синтезировать вещество, которое лучше подходило бы в качестве снотворного. Таким препаратом стал доксиламин. Первое упоминание о нем в медицинской литературе датируется 1948 г. Этот блокатор гистаминовых рецепторов не является полностью селективным, поскольку действует и на центральные, и на периферические рецепторы гистамина, на H1 и H2 их подтипы, а также на рецепторы к ацетилхолину. Но наибольшее сродство этот препарат проявляет к H1-рецепторам в головном мозге, при этом оказывается возможным подобрать дозировку, при которой будет достигаться снотворный эффект, в то время как вероятность развития нежелательных последствий окажется минимальной. Неожиданно обнаружилось, что доксиламин безопасен при беременности и в сочетании с витамином B6 может использоваться для лечения тошноты при этом состоянии. Многолетний опыт использования блокаторов доксиламиновых рецепторов показал, что, хотя они действительно улучшают сон, их нельзя использовать в течение длительного времени из-за увеличения вероятности возникновения побочных эффектов. Это касается, прежде всего, развития дневной сонливости и снижения когнитивных функций, связанных с длительным периодом полувыведения препарата (около 15 часов). Кроме того, при применении препаратов этой группы существует риск развития привыкания – уменьшения эффекта лекарственного средства с течением времени. Поэтому в настоящее время дифенилгидрамин и доксиламин в качестве снотворных рекомендуется принимать лишь при острой инсомнии для того, чтобы помочь пациенту пережить период действия стрессового фактора, например социального конфликта. Третий подход к фармакологической индукции сна заключается в использовании свойства внутренних часов (супрахиазменных ядер) влиять на взаимодействие активирующих и синхронизирующих систем мозга. Для этого используются препараты синтетического мелатонина – аналога гормона, вырабатываемого шишковидной железой (эпифиза). Раньше для этих целей использовался мелатонин, получаемый из мозга крупного рогатого скота, но в связи с потенциальной возможностью передачи через вещество мозга смертельного прионового заболевания (прионы – белки, обладающие способностью самокопироваться) – болезни Крейцфельда – Якоба – его стали производить генно-инженерным способом. Мелатонин, полученный таким путем, совершенно безопасен. 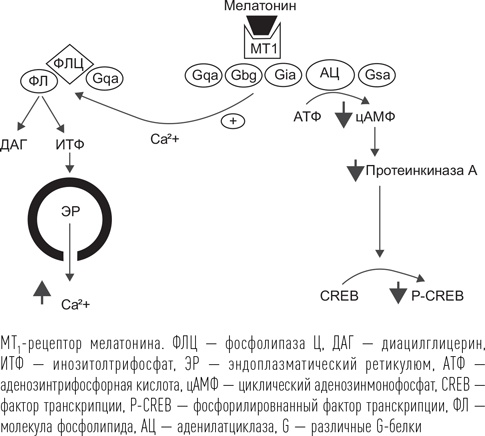
Препараты мелатонина воздействуют на специфические рецепторы 1-го и 2-го типа (МТ1 и МТ2). Рецепторы мелатонина также относятся к семейству рецепторов, связанных с G-белками, и, действуя через Gαi-белок, снижают уровень циклического аденозинмонофосфата (цАМФ). Гормон, взаимодействуя с рецептором, вызывает уменьшение образования цАМФ из АТФ, что, в свою очередь, активирует фермент протеинкиназу А, которая вызывает фосфорилирование (активацию) фактора транскрипции CREB. В итоге это приводит к изменению активности часовых генов. Также через систему инозинтрифосфата мелатонин вызывает увеличение содержания кальция (Ca2+) во внутриклеточном пространстве. Показано, что действие мелатонина на МТ1-рецепторы определяет индукцию сна у человека, а МТ2 отвечают за эффект подстройки собственного ритма внутренних часов к внешнему окружению (фазовый сдвиг). Кроме МТ1 и МТ2 мелатонин действует на особые рецепторы, которые находятся внутри клетки, в ее ядре. Это рецептор RORα, участвующий в регуляции транскрипции циркадианных генов. Связывание мелатонина с этим рецептором напрямую вызывает изменение транскрипции часовых генов BMAL1, CLOCK, PER, CRY, CKIE, что в итоге приводит к изменению мембранного потенциала клетки в сторону его уменьшения. Клетке становится труднее генерировать потенциал действия. Поскольку 99 % рецепторов мелатонина находятся в головном мозге, точнее в супрахиазменных ядрах, основное действие этот гормон оказывает, затормаживая активность внутренних часов. В результате внутренние часы перестают «помогать» активирующим мозговым системам и тормозить синхронизирующие системы и равновесие между ними смещается в пользу сна. Препараты мелатонина рекомендуется принимать в вечернее время, соответствующее началу его секреции у человека (в 21.00–22.00). Доказано, что прием мелатонина у здоровых людей сопровождается сокращением времени засыпания, а у людей с нарушениями сна – к сокращению времени засыпания и увеличению продолжительности сна. Особенностью мелатонина как лекарственного средства является его исключительная биодоступность – вследствие высокой жирорастворимости он легко проникает через мембраны клеток любого органа, включая головной мозг. Другая особенность – мелатонин очень быстро перерабатывается в печени: период его полувыведения не превышает 50 минут. Этим во многом обусловлена высокая безопасность препарата при приеме в качестве снотворного – наутро в организме не остается вещества, введенного извне. Показано, что препараты мелатонина становятся более эффективными в отношении улучшения сна по мере уменьшения его собственной продукции. В возрасте старше 55 лет собственный мелатонин почти не вырабатывается, поэтому в качестве снотворного его рекомендуется принимать, прежде всего, людям старших возрастных групп. Снотворный эффект препаратов мелатонина довольно слабый, слабее чем у любых других лекарственных препаратов, применяемых с этой целью. 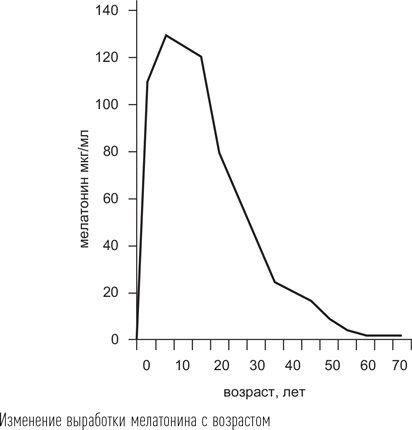
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно