
|
||
|
|
||
|
|
Онлайн книга - ДНК. История генетической революции | Автор книги - Кевин Дэвис , Эндрю Берри , Джеймс Д. Уотсон
Cтраница 138

На сегодня наиболее успешным противораковым препаратом, работающим на генетическом уровне, остается иматиниб (Gleevec). Большинство современных препаратов от лейкемии – это по-прежнему адаптированная «побочка» терапии другой онкопатологии, поскольку фармацевтические компании не склонны инвестировать средства в разработку лечения, нацеленного на относительно малую подгруппу пациентов. Однако в 1990 году, когда молодой швейцарский химик-органик Юрг Циммерманн получил в Базеле свою первую серьезную фармацевическую работу в компании Ciba-Geigy (позже она слилась с компанией Sandoz, и вместе они образовали корпорацию Novartis), ему первым делом поставили следующую задачу: синтезировать низкомолекулярные кандидатные препараты для лечения хронического миелоидного лейкоза (ХМЛ). Хотя это и не самая распространенная форма лейкемии, в мире ежегодно диагностируется около 6000 случаев ХМЛ, эта болезнь обычно приводит к смерти максимум за пять лет, и единственное доступное лечение – это трансплантация костного мозга. Однако основная причина ХМЛ была известна уже несколько десятилетий: в 1960 году двое ученых из Филадельфии описали любопытную аномалию в белых кровяных тельцах у больных. Еще через десять лет Джанет Роули, генетик из Университета Чикаго, точно описала хромосомную аномалию как филадельфийскую хромосому. Воспользовавшись новым методом окрашивания, с которым она ознакомилась во время творческого отпуска в Оксфорде, Джанет Роули смогла сделать микрофотографии хромосом с нанесенными полосками. В 1972 году она раскладывала эти снимки прямо на обеденном столе, вырезала из них изображения отдельных хромосом и аккуратно попарно складывала, уговаривая своих маленьких детей, игравших рядом, чтобы те не чихали. Оказалось, что филадельфийская хромосома – это патологическое слияние двух обычных хромосом, 9 и 22. Джанет Роули написала о своем открытии в журнале Nature. Описав хромосомные транслокации при двух других типах лейкемии, она убедилась, что именно эти аберрации и есть причина рака, а не какой-нибудь побочный эффект другого заболевания. Так появилось первое солидное доказательство, что рак возникает из-за повреждений ДНК. Аномальная хромосома, образующаяся вследствие переноса части 9-й хромосомы на 22-ю, при ХМЛ синтезирует химерный онкогенный белок BCR-ABL, который кодирует на поверхности клетки киназу, провоцирующую рост и отличающуюся при ХМЛ чрезмерной экспрессией. 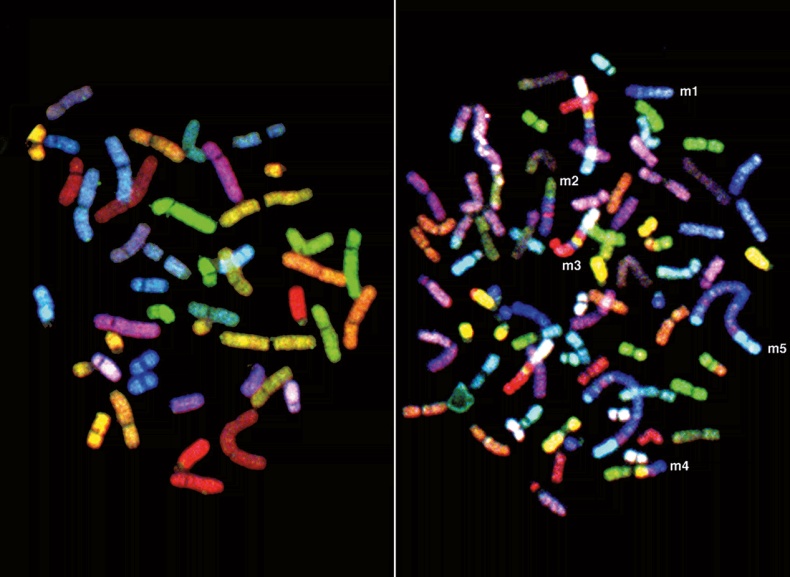
Здоровые неповрежденные хромосомы из обычной клетки (слева) и хромосомы из клеточной линии SKB3, вызывающей рак груди (справа). В сущности, все раковые хромосомы изменены (либо структурно, либо по числу копий). В двух длинных искривленных синих хромосомах содержится множество лишних копий онкогена MYC Команда Юрга Циммермана взяла «на прицел» четко обозначенную графически трехмерную модель белка-мишени, после чего ученые стали искать маленькое соединение, выстраивающееся в активный сайт гибридного белка и не дающее ему связываться с естественным субстратом (в данном случае с нуклеотидом АТФ). По признанию врача Чарльза Сойерса, позже сотрудничавшего с Novartis, до тех пор пока метод не заработал, «эта идея казалась безумной». Безумные идеи редко бывают по душе тем, кто занимается разработкой лекарств – кропотливым и заоблачно дорогим делом. В среднем на открытие препарата тратится пятнадцать лет и более миллиарда долларов; приходится провести многолетние клинические исследования, и только тогда, когда будет доказана безопасность и эффективность лекарства, наконец получить одобрение. Тем не менее Юрг Циммерманн не отчаялся и приступил к поиску известных ингибиторов других белковых киназ. Он стал экспериментировать с химической структурой известного химического соединения: добавлять группу атомов там, корректировать тут. Своему чутью он доверял больше, чем компьютерным программам для моделирования молекул. К августу 1992 года он синтезировал молекулу, получившую лабораторное название STI-571 (ингибитор сигнальной трансдукции 571). Поначалу менеджеры компании препаратом не воодушевились, поскольку, как я уже упоминал, у лекарства не было потенциала, чтобы стать «блокбастером» в фармации и давать по миллиарду долларов чистой выручки ежегодно. К счастью, тестировать соединение Циммерманна поручили онкологу Брайану Друкеру. Первые исследования показали, что препарат токсичен для собак, но Друкер смело заявил, что такой результат может и не повториться при испытаниях на людях. Действительно, по итогам первого этапа клинического исследования, запущенного в 1996 году, STI-571 оказался безопасным и удивительно эффективным. Всего за несколько недель повышенные титры белых кровяных телец у пациентов с ХМЛ вернулись к нормальным значениям. Молекула прошла и дальнейшие испытания, после чего в 2001 году FDA за рекордные десять недель одобрило препарат, сегодня известный под названием иматиниб. Это произошло всего через три года после первых клинических испытаний и через девять лет после того, как Юрг Циммерманн синтезировал это соединение. Поскольку иматиниб блокирует не только BCR-ABL, но и другие киназы, Друкер, Сойерс и их коллеги догадались, что потенциально препарат может лечить и другие виды рака, в частности гастроинтестинальную стромальную опухоль (ГИСО). ГИСО возникает из-за мутаций в онкогене c-KIT и на первый взгляд совершенно не похожа на лейкемию. Сходство выявляется лишь на уровне молекулярной генетики. Однако надежды на то, что иматиниб может полностью излечить пациента от ХМЛ, вскоре рухнули. Любая спонтанная мутация в присутствии иматиниба помогает раковым клеткам ускользать от этого препарата. Уже в ходе клинических испытаний врачи отметили, что у некоторых пациентов развилась резистентность к препарату. Одна мутация даже привела к тому, что сайт раковой клетки, продуцировавший BCR-ABL, вновь заработал на полную мощность. Клетка подставила на этот сайт вместо обычной кислоты другую, более крупную, и стала неуязвима для иматиниба. Пока Друкер и Сойерс рассказывали коллегам-онкологам о резистентности при ХМЛ, исследователи из компании Bristol-Myers Squibb разрабатывали собственный ряд ингибиторов киназ для лечения ХМЛ. Они открыли молекулу, которая, подобно иматинибу, могла блокировать BCR-ABL в его активной конфигурации. Теперь у онкологов было на выбор несколько ингибиторов киназ, в том числе нилотиниб, препарат следующего поколения от Novartis (под названием Tasigna), который случайно (или как раз кстати) поступил на рынок в 2015 году, именно тогда, когда истекал патент на Gleevec. Сейчас ведутся еще несколько исследований, призванных определить, какие комбинации препаратов обеспечивают максимальную вероятность долгосрочной ремиссии при ХМЛ. 
Боб Вайнберг (слева) и Дуглас Ханахан (справа) – исследователи, выделившие наиболее характерные признаки рака Прошло почти двадцать лет с тех пор, как Боб Вайнберг из Института Уайтхеда при Массачусетском технологическом институте и Дуглас Ханахан, на тот момент директор Института экспериментальных онкологических исследований в швейцарской Лозанне, встретившись на конференции на Гавайях (в 1998 году), решили воспользоваться своим свободным временем и вместе спуститься в кратер потухшего вулкана. Этот поход позволил им договориться, что они в соавторстве напишут обзорную статью, где, по словам Вайнберга, «попытаются кодифицировать принципы, по которым здоровая клетка превращается в раковую». Дуглас Ханахан придумал для статьи запоминающееся название: The Hallmarks of Cancer (Рак: характерные особенности), и в январе 2000 года эта статья была опубликована в журнале Cell. По признанию самого Боба Вайнберга, он ожидал, что статья «утонет, как камень в спокойном пруду; мы даже и не думали, что она получит поистине всеобщее признание в широком научном сообществе». Действительно, с тех пор ее цитировали тысячи раз – такой чести удостоились авторы, сумевшие свести к сухому остатку ошеломительно сложную биологию рака и сформулировать стройную систему из считаных фундаментальных признаков.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно