
|
||
|
|
||
|
|
Онлайн книга - Биология добра и зла. Как наука объясняет наши поступки | Автор книги - Роберт Сапольски
Cтраница 270

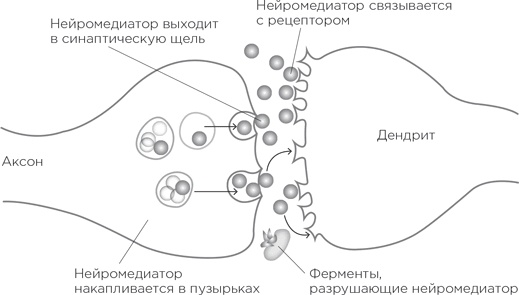
Оба способа ведения нейронного хозяйства чрезвычайно важны. Предположим, нам нужно увеличить количество нейромедиатора в синапсе. То есть, если перевести это в термины возбуждений и потенциалов, используемые в одном из предыдущих параграфов, требуется увеличить возбудимость синапса, чтобы потенциал действия в пресинаптическом нейроне погромче и поскорее отозвался в постсинаптическом; иными словами, чтобы увеличилась вероятность появления потенциала действия во втором нейроне. Можно увеличить количество нейромедиатора, высвобождаемого в синаптическое пространство, – получится погромче. А можно увеличить количество рецепторов на дендритном шипике – и получится более чуткий слух. Но есть и другая возможность: снизить активность насоса обратного захвата. В результате больше молекул нейромедиатора останется в синапсе. И они дольше будут сидеть на рецепторах или, открепившись от них, будут снова и снова с ними связываться, усиливая сигнал. Или – что в принципе то же самое – можно ослабить активность ферментов, разрушающих нейромедиатор: меньше молекул будет переводиться в нерабочее состояние и больше – оставаться в рабочем. Эффект тот же – усиление сигнала. И, как мы неоднократно видели на страницах этой книги, исследования, связанные с количеством синтезированных и высвобожденных в синапсы нейромедиаторов, количеством и функционированием рецепторов, насосов обратного захвата и ферментов, разрушающих нейромедиаторы, помогают раскрывать интереснейшие индивидуальные различия в нашем поведении. Типы нейромедиаторов
Что же представляют собой эти мифические молекулы нейромедиаторов, которые под нажимом потенциала действия выпускаются в синаптическое пространство сотнями миллиардов аксонных окончаний? Дело усложняется еще и тем, что существует не один тип нейромедиаторов. Почему не один? Ведь в каждом синапсе идет единообразный процесс, в ходе которого нейромедиатор связывается с рецептором по принципу «ключ к замку» и тем самым открывает различные каналы; ионы перетекают по ним, и шипик получает чуть менее отрицательный заряд. Но причины есть. Одна из них заключается в том, что разные нейромедиаторы дают разную длительность и степень деполяризации, т. е. обеспечивают возбуждение разной силы и продолжительности. А значит, появляется возможность усложнить проходящую от нейрона к нейрону информацию. Вторая причина сразу удвоит поле обзора: есть нейромедиаторы, которые не деполяризуют шипики и не увеличивают вероятность появления потенциала действия в следующем нейроне, а делают все наоборот. Они как раз гиперполяризуют дендритный шипик, открывая для этого другие типы каналов и еще больше сдвигая потенциал покоя в отрицательную сторону (от –70 к –80 мВ). Перед нами т. н. тормозные нейромедиаторы или ингибиторы. Теперь понятно, как усложнились наши модели – мало того, что нейрон с 10 000 дендритных шипиков получает сигналы возбуждения различной силы от разных нейронов, так ведь при этом от других он получает сигналы торможения… И все это обрабатывается в бухгалтерии аксонного холмика. Таким образом, у нас есть множество классов нейромедиаторов, и каждый связывается со своим рецептором с подходящей конфигурацией [536]. И что – в любом окончании аксона сидят все эти нейромедиаторы и потенциал действия выводит в синапс полный их ассортимент? А теперь самое время познакомиться с принципом Дейла, названным по имени его первооткрывателя Генри Дейла, великого многостаночника нейробиологии. Этот принцип, предложенный в 1930-х гг., оказался настолько верен [537], что до сих пор обеспечивает каждому нейробиологу чувство глубокой внутренней правоты. Вот этот принцип: в каждом аксонном окончании нейрона потенциал действия высвобождает в синаптическое пространство один и тот же тип нейромедиатора. Поэтому у каждого нейрона будет свой характерный нейрохимический профиль. «Данный нейрон является нейроном с нейромедиатором типа А. И это означает, что нейроны, с которыми наш нейрон связан, все имеют на дендритных шипиках рецепторы нейромедиатора А» [538]. Сейчас известны десятки нейромедиаторов. Некоторые из них хорошо нам знакомы – это серотонин, норадреналин, дофамин, ацетилхолин, глутамат (самый частый возбуждающий нейромедиатор в мозге) и ГАМК (самый частый тормозный). Для студентов-медиков данная тема – настоящая пытка, им приходится выучивать все ступени синтеза [539] этих нейромедиаторов: и предшественников, и последовательность промежуточных форм, через которые проходит молекула-предшественник, пока не дойдет до финальной рабочей молекулы, да еще безобразно длинные названия ферментов, катализирующих этапы синтеза. Но все же есть некоторые относительно простые правила, построенные на трех положениях: а) Если бежишь со всех ног от тигра, то малоприятно, когда нейроны вдруг перестают передавать сигнал мышцам, потому что – вот ведь незадача! – у них закончился нейромедиатор. Это значит, что нейромедиаторы нужно синтезировать из таких предшественников, которых в организме много; зачастую ими являются простые компоненты пищи. Например, серотонин и дофамин производятся из пищевых аминокислот – триптофана и тирозина соответственно. А ацетилхолин – из холина и лецитина. б) Нейрон может производить в секунду десятки потенциалов действия. При каждом нужно заново заполнить пузырьки нейромедиатором, потом запустить его в синаптическую щель, а затем забрать обратно внутрь аксонного окончания. Поэтому хотелось бы, чтобы молекула нейромедиатора не была огромной, слишком сложной и с затейливыми финтифлюшками, для которых потребовались бы специальные бригады строителей. Такие молекулы, наоборот, должны синтезироваться из предшественников на раз-два, за несколько шагов. Им следует быть дешевыми и простыми в исполнении. Так, синтез дофамина из тирозина идет всего в два несложных этапа.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно