
|
||
|
|
||
|
|
Онлайн книга - Квант | Автор книги - Манжит Кумар
Cтраница 30

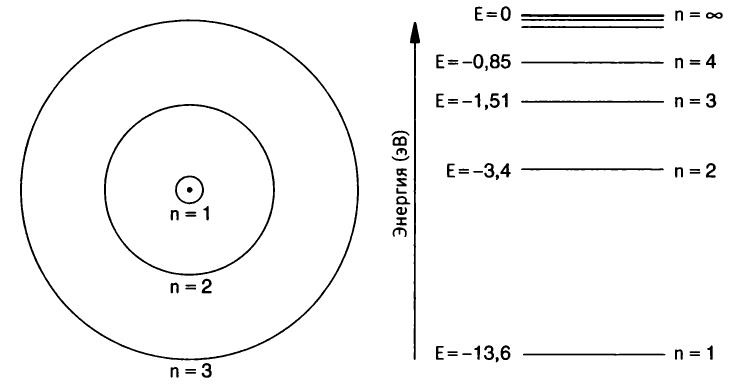
Бор вычислил значения энергий стационарных состояний для атома водорода и показал, что энергия уровня n равна энергии основного состояния, деленной на n2, то есть (E/n2). Это значит, что при n = 2, в первом возбужденном состоянии, энергия равна -13,6 ÷ 4 = - 3,40 эВ. Радиус первой электронной орбиты, n = 1, определяет размер атома водорода в основном состоянии. В рамках модели Бора этот радиус, в согласии с самыми точными современными экспериментальными оценками, равен 5,3 нанометра (нм). Нанометр — единица длины, равная одной миллиардной части метра. Бор показал, что радиусы других разрешенных орбит растут как r2: если при n = 1 радиус равен r, то радиус орбиты при n = 2 равен 4r, при n = 3 он равен 9r, и так далее.
Рис. 6. Несколько стационарных состояний и соответствующие им энергетические уровни атома водорода (рисунок не в масштабе) Тридцать первого января 1913 года Бор написал Резерфорду: “Надеюсь, скоро мне удастся отправить статью про атомы в печать. Я потратил на нее гораздо больше времени, чем предполагал, но, кажется, за последнее время мне удалось добиться существенного прогресса”19. Квантуя угловой момент орбитальных электронов, Бор смог добиться стабильности атома с ядром. Так он объяснил, почему электроны могут занимать не произвольные, а только строго определенные орбиты, то есть находиться только в стационарных состояниях. Через несколько дней после отправки письма Резерфорду Бор нашел третий, последний, ключ, позволивший ему завершить построение квантовой модели атома. В это время Ханс Мариус Хансен, с которым Бор в студенческие годы дружил (тот был на год моложе) в Копенгагене, вернулся в датскую столицу, закончив обучение в Геттингене. Когда они с Бором встретились, тот рассказал товарищу о своих соображениях относительно структуры атома. В Германии Хансен занимался исследованиями в области спектроскопии. Он изучал поглощение и испускание излучения атомами и молекулами. Хансен спросил Бора, могут ли его идеи пролить свет на загадку образования спектральных линий. Уже давно было известно, что в зависимости оттого, испарение какого металла происходит при горении, открытое пламя меняет цвет. Оно становится ярко желтым вблизи натрия, темно-красным вблизи лития, фиолетовым вблизи калия. Еще в XIX веке было обнаружено, что каждый элемент приводит к образованию уникального набора спектральных линий: очень узких участков спектров, на которых интенсивность излучения сильно возрастает либо сильно ослаблена. Число, расстояние и длины волн спектральных линий, генерируемых атомами каждого из элементов, уникальны. Это как бы отпечатки пальцев, по которым элементы можно распознавать. Спектры очень сложны. Различным элементам соответствует невероятно большое число разнообразных вариантов расположения и интенсивности спектральных линий. Поэтому трудно себе представить, что именно они послужили ключом к пониманию внутренней структуры атома. Всем интересно разглядывать цветной узор на крыльях бабочек, но, как сказал позднее Бор, “никто не думает, что, глядя на раскраску их крыльев, можно понять основы биологии”20. Связь между спектральными линиями и атомами была очевидна, но в феврале 1913 года Бор совершенно не представлял себе, в чем она состоит. Хансен предложил Бору взглянуть на формулу Бальмера для спектральных линий водорода. Насколько Бор помнил, он никогда о такой формуле не слышал. Более вероятно, что он просто забыл ее. Хансен записал формулу и пояснил: никто не понимает, почему она работает. Иоганн Бальмер — швейцарский математик, преподававший в школе для девочек в Базеле и по совместительству читавший лекции в местном университете. Однажды Бальмер пожаловался коллегам, что ему нечего делать. Они, зная его пристрастие к нумерологии, рассказали о четырех спектральных линиях водорода. Заинтригованный Бальмер решил, что сможет описать все четыре линии одной математической формулой. Правда, всем казалось, что такой формулы быть не может. В середине XIX века шведский физик Андерс Ангстрем измерил с очень высокой точностью длины волн четырех спектральных линий водорода в красной, зеленой, голубой и фиолетовой областях видимого спектра. Обозначив их “альфа”, “бета”, “гамма” и “дельта”, он получил, что соответствующие им длины волн суть 656,210; 486,074; 434,01 и 410,12 нм21. В июне 1884 года, на пороге своего шестидесятилетия, Бальмеру удалось получить формулу, с помощью которой можно было вычислить длины волн (λ) каждой из этих четырех спектральных линий. Значения λ = b [т2 / (т2 — n2)], где m и n — целые числа, а b — константа, которая определяется из эксперимента. Она равна 364.56 нм. Бальмер показал, что если положить n равным 2 и считать, что m принимает значения 3,4,5 или 6, то приведенная формула практически точно воспроизводит искомую последовательность длин волн. Например, если в формулу подставить n = 2 и m = 3, то получается длина волны красной альфа-линии. Однако Бальмер сделал нечто большее. Он не просто воспроизвел длины волн известных четырех линий, которые позднее были названы в его честь серией Бальмера. Он предсказал существование пятой линии для n = 2 и m = 7. Бальмер не подозревал, что Ангстрем, работа которого была опубликована в Швеции, уже открыл такую линию и измерил ее длину волны. Два значения, экспериментальное и теоретическое, совпадали почти идеально. Ангстрем умер в 1874 году в возрасте пятидесяти девяти лет. Если бы он прожил дольше, он удивился бы, узнав, что Бальмер, использовав свою формулу, предсказал существование других серий спектральных линий для атома водорода. Эти серии попадают в инфракрасную и ультрафиолетовую области спектра. Бальмер просто положил n равным 1, 3, 4 и 5 и, как и в случае n = 2, позволил m принимать ряд других целочисленных значений. Например, Бальмер предсказал, что при n = 3 и m = 4, или 5, или 6, или 7 существует серия линий в инфракрасном диапазоне. Эта серия линий была открыта в 1908 году Фридрихом Пашеном. Все предсказанные Бальмером серии линий были обнаружены, но никто не мог объяснить, почему его формула оказалась правильной. Какой физический смысл могла иметь формула, полученная подбором, путем проб и ошибок? Позднее Бор скажет: “Как только я увидел формулу Бальмера, мне немедленно стало все совершенно ясно”22. Спектральные линии атома определяются перескоками электронов с одной разрешенной орбиты на другую. Если атом водорода, находящийся в основном состоянии, n = 1, поглощает достаточно энергии, электрон “перескакивает” на орбиту n = 2, соответствующую более высокой энергии. Это значит, что атом находится в нестабильном, возбужденном состоянии и быстро возвращается в стабильное основное состояние, перепрыгнув из состояния с n = 2 в состояние с n = 1. Он может это сделать, только испустив квант энергии, равный разности энергий этих уровней. В данном случае это 10,2 эВ. Длину волны соответствующей спектральной линии можно вычислить, используя формулу Планка E = hν, где ν — частота испускаемого электромагнитного излучения. |
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно