
|
||
|
|
||
|
|
Онлайн книга - Физика на пальцах. Для детей и родителей, которые хотят объяснять детям | Автор книги - Александр Никонов
Cтраница 57

Углерод — С (6 протонов, 6 нейтронов, 6 электронов)
Копоть, сажа, уголь — это и есть углерод практически в чистом виде. Черное пачкающее вещество. Правда, сегодня городскому жителю углерод чаще всего встречается в виде графита, то есть в виде грифеля в простом карандаше. Это тоже пачкающее, мягкое серо-черное вещество. Здесь его пачкающие свойства применяют с пользой — чтобы оставлять следы на бумаге. Однако есть и другие формы существования углерода — совершенно не черные, не пачкающие и не мягкие, а совсем даже напротив — прозрачные и очень твердые. Такая форма существования углерода называется алмазом. Если грифель растирается в пыль руками, то алмаз — самое твердое вещество на Земле. И кто скажет, что он пачкается? Он прекрасен! Это вам любая женщина подтвердит. Но каков фокус! С одной стороны — нечто черное, непрозрачное, проводящее электрический ток и очень мягкое. С другой — бесцветный, прозрачный, невероятно твердый изолятор (материал, не проводящий ток). И это все — одно и то же вещество! Почему? Фазовый переход, друзья мои! При определенных (очень высоких) температурах и давлениях графит превращается в алмаз. Химически он остается все тем же веществом, но его физические свойства, как видите, меняются кардинально. А все из-за того, что перестраивается кристаллическая решетка. 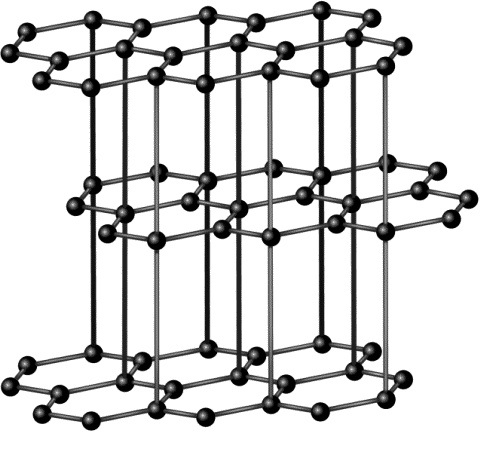
Так упакованы атомы в графите 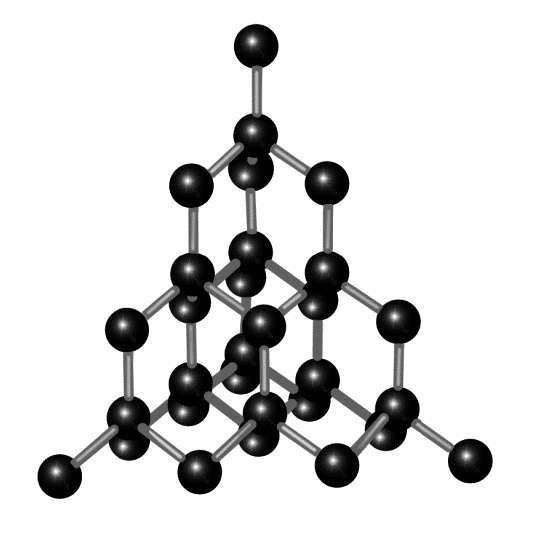
А так они располагаются в алмазе Однако при прямо противоположных физических свойствах своих химических «привычек» алмаз не лишился. Он точно так же может прореагировать с кислородом (О) и полностью окислиться, то есть сгореть без остатка, целиком превратившись в углекислый газ (СО2). Углерод — один из важнейших для жизни элементов. Собственно, жизнь из него и «сделана». Этот элемент обладает чудесным свойством выстраивать сам с собой, а также с другими элементами длинные молекулы, именуемые полимерами. Из таких длинных атомных цепочек и строится вся органика, то есть, грубо говоря, «живое вещество». Азот (N), стоящий в таблице Менделеева правее углерода, — это газ. И соседний кислород (O) тоже газ. И фтор (F) — газ. А вот более легкий, чем эти трое, углерод — почему-то представляет собой твердое вещество. Почему? Потому что он, в отличие от кислорода, азота и фтора, не образует легких молекул из двух атомов, типа О2, N2 и F2. Сила связи между атомами кислорода в одной молекуле кислорода О2 велика, а между разными молекулами кислорода слаба — вот они и разлетаются в разные стороны. Зато в алмазе, например, все атомы углерода связаны друг с другом одинаково крепко — в один сплошной полимер. Можно сказать, что кристалл алмаза — это одна сверхгигантская молекула. И конечно, такая сверхтяжелая «молекула» газом быть никак не может. Тот раздел химии, который изучает углеродные полимеры, называется органической химией. Углеродные цепочки — тот «скелет», на котором строятся молекулы жизни. Круговорот углерода в природе прост — животные дышат кислородом, а выдыхают углекислый газ (СО2), связывая таким образом углерод. Растения же, напротив, дышат углекислым газом, выдыхая в атмосферу кислород, а высвобожденный углерод пускают на строительство своего «тела» — ствола, листьев, корней. Потом растения поедаются животными, и углерод, как главный строительный материал всего живого, поступает в их тела. В человеке массой 70 кг содержится 15 кг углерода. Больше, чем углерода, в организме человека только кислорода — почти 45 кг. А водорода — 6 кг. При этом атомов водорода в штуках почти в два раза больше, чем атомов кислорода, просто водород очень легкий. Водород и кислород присутствуют в нашем организме в основном в виде воды, из который человек состоит на 70 %. Человек, по сути, это водный пузырь, армированный костями. Точнее, миллиарды микроскопических водяных пузыриков, именуемых клетками. Все жизненные реакции внутри нас идут в водном растворе. Фтор — F (9 p+, 10 n, 9 e-)
Это, пожалуй, самый агрессивный элемент из существующих, стремящийся прореагировать со всем, что попадается ему «под руку». Фтор находится в правом верхнем углу таблицы Менделеева, что уже говорит о многом. Это практически полюс системы элементов, самая ее крайность. Мы привыкли тушить огонь водой, потому что вода негорюча. Но в атмосфере фтора горит даже вода, высвобождая кислород и образуя фторид водорода (HF). Если этот фторид растворить в воде, то получится плавиковая кислота — самая агрессивная кислота из известных нам. Обычную кислоту (серную, соляную и пр.) можно хранить в стеклянных сосудах. А плавиковая разъедает даже стекло, поэтому ее хранят в специальных фторопластовых емкостях. Если в атмосферу фтора бросить кремний или уголь, то их даже поджигать будет не надо — сами воспламенятся, настолько хочется фтору с чем-нибудь пореагировать! Не зря его так назвали: «фтор», что в переводе с греческого означает «разрушающий». Опасная штука! В атмосфере фтора горят и кирпич, и асбест, и многие металлы. Однако в малых дозах фтор может быть и полезен. В микроскопических количествах мы получаем фтор с водой, и он, встраиваясь в наш организм, попадает в зубную ткань и позволяет зубам бороться с бактериями, вызывающими кариес, то есть гниение зубов. Но стоит только содержанию фтора в воде превысить допустимые нормы, как зубы и весь организм начинают активно разрушаться. В организме человека содержится примерно 3 мг фтора. И еще — именно фтор, наряду с тяжелой водой, помог сделать атомную бомбу. Для бомбы необходим уран-235, который надо было отделить от урана-238. Химически их не разделишь, это одно и то же вещество. Как же выделить из урана атомы, в ядрах которых 235 нуклонов, отделив их от атомов, где 238 нуклонов? Можно попробовать использовать центрифуги — раскручивать жидкость, и тогда чуть более легкие фракции (атомы) станут отбрасываться центробежной силой чуть дальше. Затем это более легкое отбирать, снова запускать на центрифугу и таким образом раз за разом обогащать нужными нам фракциями. Именно так отделяют тяжелую воду от обычной, легкой. Но беда в том, что уран — не жидкость, а металл. Что же делать? Выход нашелся. Фторид урана, то есть соединение урана с фтором — легкоплавкое вещество, которое можно при невысоких температурах сделать жидкостью и подвергнуть сепарации. А уж затем, после сепарации, снова выделить из фторида чистый уран, уже разделенный. Азот — N (7p+, 7n, 7e-)
Воздух по большей части состоит из него, родимого. Напомню: азота в атмосфере около 80 %, а кислорода — 20 %. Так что дышим мы в основном им. В организме для реакций используется только вдыхаемый кислород, азот же играет роль балласта — как вдыхается, так в неизменном виде и выдыхается. Но балласт этот не бесполезен! Дышать одним только чистым кислородом смертельно опасно.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно