
|
||
|
|
||
|
|
Онлайн книга - Физика на пальцах. Для детей и родителей, которые хотят объяснять детям | Автор книги - Александр Никонов
Cтраница 12

Иногда еще атомную массу называют атомным весом. Мы знаем, что вес и масса — разные вещи, но так сложилось в науке, что атомный вес является синонимом атомной массы. Примем это как данность. Жалко что ли? Мы же говорим «чайник закипел», хотя кипит вовсе не чайник, а вода в чайнике. 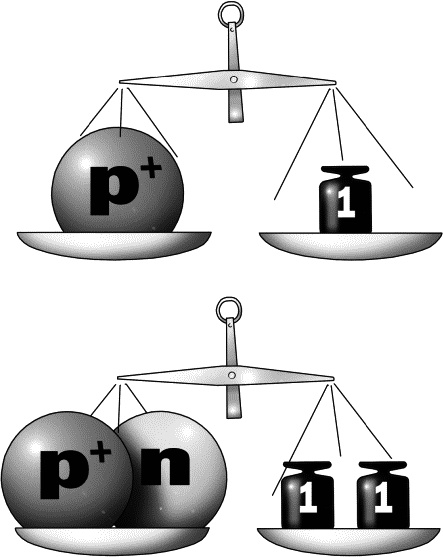
В мире атомов вес измеряется в атомных единицах Так вот, каков атомный вес водорода? Одна атомная единица! Потому что в его ядре один нуклон. А у гелия? Четыре! Потому что в ядре гелия четыре нуклона — две гирьки протонов, а еще и две гирьки нейтронов. (Электроны при определении атомного веса не учитываются из-за чрезвычайной легкости.) Проще говоря, атомная масса, которая указана возле каждого элемента в таблице Менделеева до запятой — это общее количество нуклонов (протонов и нейтронов) в его ядре. Посмотрите, в ядре атома золота 196 частиц. Протонов там, как мы уже выяснили, 79 штук. Все остальное — нейтроны. Возьмите калькулятор и посчитайте… Не хотите? Ну, ладно, я за вас посчитаю: 196 — 79 = 117 Получается, у золота 117 нейтронов в атоме. Внимательный детский глаз может, еще раз оглядев клеточку золота, вырезанную из менделеевской таблицы, послать сигнал в хитрый детский мозг, и мозг озаботится ненужным вопросом: — Дяденька писатель! А что там еще за цифры стоят после запятой? Ну, после 196? Ох, не хотел я вам этого говорить, дети, хотел утаить, но раз к стенке приперли, придется расколоться. Это очень трудно, друзья мои! Не каждый взрослый об этом знает! А вы поймете за одну минуту. В обычном нормальном атоме золота, как мы уже выяснили, 117 нейтронов и 79 протонов. Но иногда встречаются атомы-уродцы. Довольно редко. У них есть лишние нейтроны. Как иногда у людей бывает по шесть пальцев на руках. Нечастое явление. Предположим, на тысячу нормальных атомов приходится один дефектный. И если в норме в атоме золота 117 нейтронов, то иногда встречаются «вспухшие» уродливые атомы, в которых 118 нейтронов. Все помидорчики как помидорчики, а у одного помидора какой-то уродский вырост на боку. Ничего, мы и такой съедим. Атомы-уродцы называют изотопами. Именно из-за них, кособоких паразитов средний вес всех атомов отличается от целого числа. Что понятно: если у нас из десяти атомов все десять имеют атомный вес в 6 единиц, то и средний атомный весь будет равен ровно шести: (6+6+6+6+6+6+6+6+6+6): 10 = 6 А вот если один из десяти атомов имеет вес в 7 единиц, средний вес изменится: (6+6+6+6+6+7+6+6+6+6): 10 = 6, 1 Видите, после запятой появилась циферка, которая говорит о том, что не «все шестерки одинаковы». Если вы внимательно посмотрите на атомные веса элементов в таблице Менделеева, то увидите, что все они не являются целыми числами. Значит, каждое элементарное вещество имеет уродливые атомы. Даже водород. Хотя, казалось бы, проще водорода ничего быть не может — один протон, вокруг которого крутится один электрон, вот и весь атом. Эта не какой-нибудь свинец, у которого в ядре больше двух сотен нуклонов, а вокруг этого огромного ядра кружится больше восьмидесяти электронов! Однако все же бывают атомы водорода, в ядре которых, кроме протона, есть еще и нейтрон. Один. А порой и два! Такой водород называют тяжелым. Потому что его атом тяжелее обычного. На рисунке ниже нарисованы атомы нормального водорода и редкие уродики, а также написано, как эти уродики называются. Но так как атомы-уродцы встречаются редко, говорить мы о них пока прекращаем. Я рассказал вам про изотопы лишь затем, чтобы объяснить наличие циферок после запятой. Вы на эти циферки просто внимания не обращайте да и все. 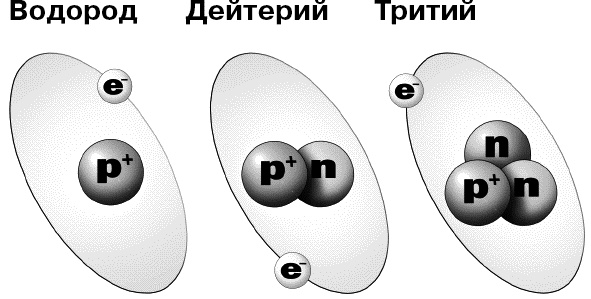
Вы теперь и так знаете слишком много! Вы представляете, по каким принципам строится вещество. Берите любой атом из таблицы Менделеева и рассказывайте про него маме или даже папе. Задавайте контрольные вопросы. Проверяйте усвоенный материал. А пока взрослые морщат лоб и мычат в свое оправдание что-то типа «я, конечно, в школе учи-и-ил, но забы-ы-ыл», мы с вами возьмем сейчас тот же хлор и натрий, из которого ранее соль поваренную делали, и посмотрим, что тут к чему. Натрий. Легкий металл. Как он сделан? Его номер 11-й. Значит, 11 протонов и 11 электронов. Атомный вес натрия — 22. То есть в ядре 22 нуклона. 22 нуклона минус 11 протонов = 11 нейтронов. Все. Атом натрия готов. Теперь хлор надо собрать по инструкции дяденьки Менделеева. У хлора номер 17. То есть 17 протонов и 17 электронов. Атомный вес (число нуклонов в ядре) — 35. 35 — 17 = 18 нейтронов. Все, собрали хлор. Теперь соединяем два этих атома — хлора и натрия, — зацепив один за другой колечками самых дальних электронных орбит, и получаем сложное вещество — молекулу поваренной соли. Так строятся все вещества — сцепляясь дальними орбитами электронов. При этом дальние электрончики, которые крутились на этих орбитах, становятся как бы общими для обоих ядер. Все, можно стереть пот со лба. Мы освоили химию и физику элементарных частиц. Слава Менделееву! Науке слава! 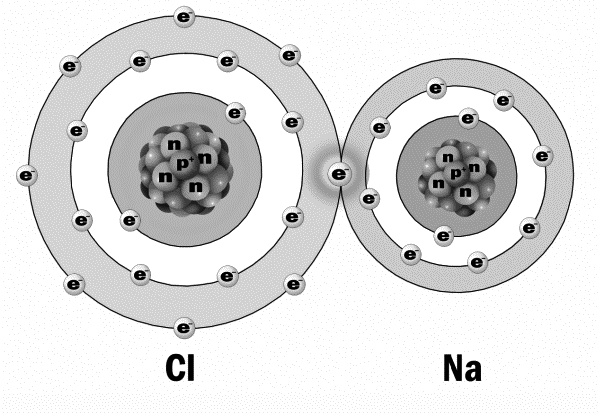
Молекула поваренной соли — хлорид натрия. Кушать подано! Теперь осталась одна маленькая деталь, которую нужно знать каждому приличному ребенку. Один маленький штрих, который завершит картину мироздания, сделав ее в ваших блестящих глазах более полной и блестящей. Итак, мы знаем, что практически все окружающее нас вещество электронейтрально. Если вы дотрагиваетесь до шкафа, он не бьет вас током. Потому что в веществе шкафа количество положительных зарядов равно количеству отрицательных. Его атомы электронейтральны. Но что будет, если атом потеряет один или два электрона? Вот такой рассеянный атом. Может такое быть? Может! Какое-нибудь сильное воздействие может парочку электрончиков у атома оторвать. Вы скажете (подсмотрев в таблицу Менделеева): — Ха! Даже если такое случится, невелика потеря! Вокруг ядра атома могут крутиться под сотню электронов! Например, у радия их 88. Некисло так! Подумаешь, пару потеряет…
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно