
|
||
|
|
||
|
|
Онлайн книга - Рождение сложности. Эволюционная биология сегодня. Неожиданные открытия и новые вопросы | Автор книги - Александр Марков
Cтраница 42

Жизненные задачи тоже у всех организмов сходны (выжить, добыть нужные вещества и энергию, вырасти, противостоять внешним разрушающим воздействиям, оставить потомство). Поэтому все имеющиеся в наличии на нашей планете фрагменты ДНК, во-первых, понятны для всего живого (могут быть более-менее адекватно прочтены и «интерпретированы» любой живой клеткой [45]), во-вторых, все они являются фрагментами устройств, сходных по своим функциям. Это резко повышает вероятность того, что случайное комбинирование фрагментов (например, в ходе горизонтального обмена генами, о котором рассказано в главе «Наследуются ли приобретенные признаки?») может породить что-то новое и осмысленное. Была раньше такая хорошая игрушка — радиоконструктор (что-то вроде нынешнего «Лего», только из конденсаторов, ламп, катушек и прочих радиодеталей). Простые работающие устройства — такие, например, как детекторный приемник — из этого конструктора собирались с достаточно высокой вероятностью путем абсолютно случайного, произвольного соединения деталек. Этот пример показывает, что если «детальки» хороши, то даже случайное их комбинирование вполне может породить что-то полезное и жизнеспособное. А в «эволюционном конструкторе» детальки, несомненно, самого высшего сорта — отшлифованные естественным отбором, проверенные и испытанные многими поколениями живых «испытателей». Кроме того, геном организма или отдельный ген — это далеко не «Война и мир», а нечто гораздо более помехоустойчивое. Если мы заменим случайным образом букву, слово или предложение в талантливом романе, то наверняка хоть чуть-чуть, но испортим произведение. Если мы заменим в гене нуклеотид или в белке аминокислоту, с очень большой вероятностью не произойдет абсолютно ничего плохого (более того, есть даже вполне реальный шанс, что изменение окажется полезным, но об этом чуть позже). Белковая молекула обычно состоит из нескольких сотен аминокислот, но только очень немногие из них действительно необходимы для того, чтобы белок исправно выполнял свою функцию. Если речь идет о ферменте, то для его работы абсолютно необходимы в основном те аминокислоты, которые составляют так называемый «активный центр». Активный центр — это то место белковой молекулы, которое, собственно, и катализирует реакцию. Кроме того, могут оказаться важными и некоторые аминокислоты, определяющие пространственную конфигурацию молекулы — то, в какую фигуру она самопроизвольно «свернется» после того, как будет синтезирована. Например, в построении пространственной структуры фермента участвуют цистеины — это аминокислоты, содержащие серу, которые образуют дисульфидные мостики (-S-S-), скрепляющие между собой различные витки, лопасти и спирали белковой молекулы. Такие принципиально важные аминокислоты составляют лишь малую часть белка. Более того, это даже не конкретные наборы аминокислот, которые должны находиться в строго определенных местах белковой молекулы, а довольно расплывчатые «рисунки», «паттерны», или, как их официально называют, мотивы. ————— Белки с одинаковой функцией могут сильно различаться по структуре. Вот аминокислотная последовательность фермента фруктозо-бисфосфат альдолазы жгутиконосца Euglena gracilis. Это один из ферментов гликолиза — важного биохимического процесса, в ходе которого, как мы помним, клетка тратит часть энергии, заключенной в молекуле глюкозы, для синтеза двух молекул АТФ без использования кислорода. Каждая буква соответствует определенной аминокислоте (P — пролин, D — аспарагиновая кислота, F — фенилаланин, K — лизин и т. д.):
А вот тот же самый фермент бактерии Mycoplasma pneumoniae:
На первый взгляд заметить сходство между этими белками очень непросто. На второй, впрочем, тоже. А ведь это, по молекулярно-генетическим меркам, весьма похожие друг на друга, близкородственные белки! У них есть длинный сходный участок (от 16-й до 333-й аминокислоты первой молекулы и от 5-й до 265-й аминокислоты второй), в пределах которого совпадает целых 25% аминокислот. Кроме того, некоторые другие аминокислоты в двух белках хотя и разные, но близкие по своим химическим свойствам.
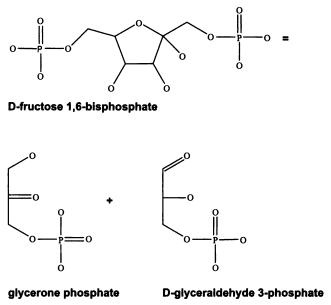
Реакция, которую катализирует фермент фруктозо-бисфосфат альдолазы. Для того чтобы обнаружить это сходство и оценить его количественно, можно воспользоваться специальной программой BLAST, свободно доступной в Интернете по адресу http://www.ncbi.nlm.nih.gov/blast/bl2seq/wblast2.cgi. Taм надо просто вставить две аминокислотные последовательности в два окошка и нажать кнопку. Такой уровень сходства при сравнении белков представителей разных надцарств живой природы (мы сравнивали эукариот с бактериями) считается очень высоким. В данном случае, возможно, этот результат объясняется тем, что предки эвглены сравнительно недавно приобрели соответствующий ген путем горизонтального переноса от каких-то бактерий. У высших эукариот фруктозо-бисфосфат альдолазы этого семейства вообще не встречаются. У нас с вами, например, они совсем другие. Читатель может попробовать самостоятельно сравнить между собой фруктозо-бисфосфат альдолазы различных организмов (найти их можно, например, в базе данных PFAM http://pfam.sanger.ac.uk/, осуществив поиск по ключевым словам «fructose bisphosphate aldolase»). Любой желающий может легко убедиться, что если сравнить один и тот же (по функции) фермент, взятый у человека и, допустим, у кишечной палочки Escherichia coli, то программа сравнения, скорее всего, выдаст безрадостное «no significant similarity found» — «значимого сходства не обнаружено». Это, впрочем, не значит, что никакого сходства действительно нет — оно есть (это те самые неопределенные «мотивы», о которых шла речь выше), но для его выявления необходимы более мощные аналитические средства, чем программа BLAST.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно