
|
||
|
|
||
|
|
Онлайн книга - Секреты вечной молодости | Автор книги - Алексей Москалев
Cтраница 24

Исследования хондропротекторов пока что приводят к успехам в лечении лишь на модели животных. Употребление гидролизата коллагена (его аналогом может служить холодец) способствовало частичному восстановлению хряща и снижению воспаления в суставах у мышей. Хлорогеновая кислота (она содержится в зернах кофе, семенах подсолнечника, цикории) защищала суставные хрящи у крыс от дальнейшей деградации, воспаления и окислительного стресса. Местная ренин-ангиотензиновая система играет важную роль в патогенезе и прогрессировании остеоартрита. Ингибитор ренина, разработанный в качестве лекарственного средства при гипертонии, оказался хондропротектором на модели крыс с заболеванием суставов. У крыс также отмечалось хондропротекторное и противовоспалительное действие глюкозамина. Однако стоит учитывать, что прием глюкозамина может способствовать развитию инсулинор езистентно сти. Здоровье печени
Печень — самый большой орган в брюшной полости: она весит около 1,4 кг. Печень выполняет многие важные функции, такие как выработка желчи и основных белков крови, преобразование нутриентов в энергию, запасание энергии, выработка тепла и очищение крови от алкоголя и токсинов. Из-за больших нагрузок, соприкосновения с инфекциями и токсинами печень очень часто повреждается (см. рисунок). Сутулость, висцеральное ожирение, гиподинамия — это факторы, которые приводят к сдавлению и нарушению кровоснабжения печени и повышают риск заболеваний этого органа. Неалкогольная жировая болезнь печени является одной из наиболее частых причин проблем со здоровьем в промышленно развитых странах. Самая ранняя ее стадия — это стеатоз печени, который определяется концентрацией триглицеридов в печени, превышающей 55 мг/г печени (5,5 %). В этом случае происходят нарушение регуляции в печени липидного метаболизма, активизация образования жира и свободного холестерина и уменьшение количества липопротеинов высокой плотности. Чрезмерное накопление липидов активирует несколько клеточных стрессовых путей, вызывая окислительный стресс и стресс эндоплазматической сети. Эндоплазматическая сеть отвечает за внутриклеточную транспортировку белков, обезвреживание токсинов и формирование клеточных мембран. Реакции стресса эндоплазматической сети могут вызывать накопление жира в ткани печени, невосприимчивость к инсулину, воспаление и гибель клеток печени (гепатоцитов). Все эти процессы играют решающую роль в патогенезе неалкогольного перерождения печени. 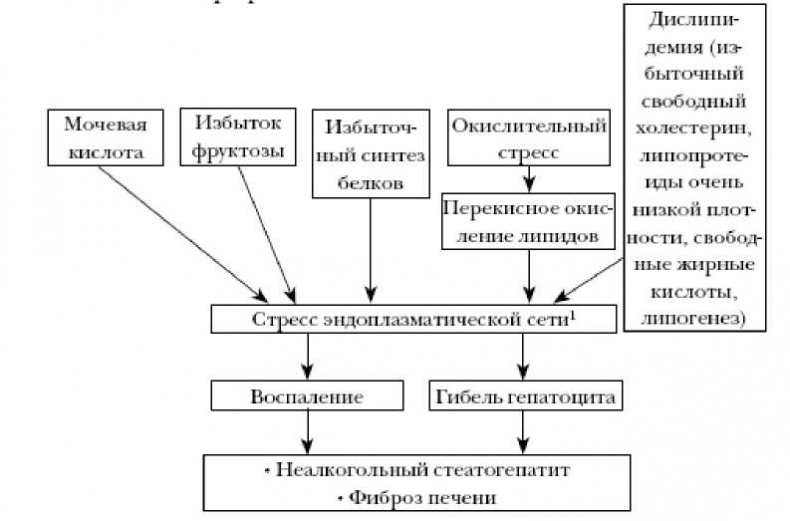
Схема. Механизмы жирового перерождения печени. Стресс эндоплазматической сети [3] Неалкогольная жировая болезнь печени может прогрессировать до безалкогольного стеатогепатита, который характеризуется признаками повреждения гепатоцита, воспаления тканей печени и отложением белка соединительной ткани коллагена. Приблизительно от 10 до 29 % пациентов с неалкогольным стеатогепатозом приобретают цирроз в течение 10 лет. Неалкогольная жировая болезнь печени является предиктором сердечно — сосудистых заболеваний даже в большей степени, чем периферическая или висцеральная жировая масса. Распространенность этой болезни печени составляет около 15 % у пациентов, не страдающих ожирением, однако у пациентов с ожирением (с индексом массы тела (ИМТ) от 30,0 до 39,9 кг/м2) и пациентов с экстремальным ожирением (ИМТ > 40,0 кг/м2) она возрастает до 65 и 85 % соответственно. В среднем этим заболеванием страдают около 30 % взрослого населения, и оно зачастую протекает бессимптомно. Кроме того, с каждым годом растет доля детей с данным заболеванием. Даже кратковременное высококалорийное питание приводит к увеличению содержания жиров в печени, в то время как кратковременное низкокалорийное питание приводит к уменьшению количества жиров даже несмотря на то, что общая масса тела при этом практически не меняется. Таким образом, избыточная калорийность пищи непосредственно влияет на риск развития неалкогольного жирового перерождения печени. Нездоровый характер питания, включая привычку употреблять слишком много калорий на ужин, есть по ночам, пропускать завтрак и есть слишком быстро, часто наблюдаются у пациентов с ожирением и неалкогольной жировой болезнью печени. Быстрые углеводы являются основным стимулом для липогенеза в печени и вносят даже более существенный вклад в неалкогольную жировую болезнь печени по сравнению с насыщенными жирами. Риск заболевания возрастает при наличии гормональных проблем — низкой функции щитовидной железы, половых желез и высокой активности надпочечников. Важную роль играет также невосприимчивость к инсулину, которая обусловлена хроническим воспалением и ожирением. Ключевым подходом немедикаментозного лечения заболевания является борьба с лишним весом. Для улучшения состояния при стеатозе достаточно потери 3–5 % массы тела, более 5 % потребуется для регенерации поврежденных клеток печени, снижения воспаления и восстановления чувствительности гепатоцитов к инсулину, более 7 % — для прекращения стеатогепатита и 10 % или более — для частичного обращения вспять фиброза. Таким образом, в лечении неалкогольной жировой болезни печени ключевую роль играют изменения образа жизни пациентов, особенно сбалансированная диета. Адаптированная схема питания позволяет сбросить лишний вес и улучшить клиническую картину этого заболевания. Сокращение калорийности ежедневного приема пищи на 500 ккал позволит снижать вес тела на 500 г в неделю. Согласно рекомендациям по питанию для пациентов с неалкогольным стеатогепатитом углеводы должны составлять 40–50 % от общего количества потребляемой энергии. Целесообразно увеличить количество сложных углеводов и клетчатки. Важную роль в этиологии заболевания играет чрезмерное потребление фруктозы (она в большом количестве содержится в прохладительных напитках и сладких фруктах), которую необходимо ограничить. Потребление фруктозы вызывает развитие ожирения печени благодаря стимуляции образования жира в гепатоцитах. Количество простых углеводов (сахарозы, глюкозы, фруктозы, лактозы) не должно превышать 10 % от общего потребления энергии. При этом олигофруктоза будет полезна. Олигофруктоза — это неперевариваемый углевод, который содержится в растительной пище, такой как цикорий, артишок, лук-порей, спаржа и чеснок. Клинические испытания, проведенные на людях, показали, что употребление олигофруктозы вызывает снижение уровня триглицеридов и уровня глюкозы в сыворотке крови. Олигофруктоза снимает воспаление в печени и уровень гормона голода грелина и приводит к увеличению концентрации гормона GLP-1 (глюкагоноподобный пептид 1), который снижает аппетит, уровень глюкозы в крови и массу тела. Сокращение калорийности ежедневного приема пищи на 500 ккал позволит снижать вес тела на 500 г в неделю. Потребление жиров должно составлять менее 30 % суточных калорий. Насыщенные жирные кислоты в избытке способствуют повреждению митохондрий и гепатоцитов в результате окислительного стресса. Чрезмерное количество стеариновой и пальмитиновой насыщенных жирных кислот (они содержатся в сливочном масле и свином сале) могут приводить к гибели клеток печени. Потребление насыщенных жирных кислот более 10 % от общей энергии может стимулировать резистентность к инсулину и ухудшать липидный профиль крови. Ограничение потребления насыщенных жиров до количества менее 7 % от общей потребляемой энергии не приводит к улучшениям в липидном профиле и может даже нанести ущерб здоровью пациента, поэтому рекомендуемое суточное потребление этих жиров должно составлять более 7 %, но менее 10 % от общего потребления энергии.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно