
|
||
|
|
||
|
|
Онлайн книга - Красота физики. Постигая устройство природы | Автор книги - Фрэнк Вильчек
Cтраница 55

Оказывается, что у этих двух новых видов орбиталей практически одна и та же энергия, поэтому электроны могут занимать их по выбору без запретительно больших энергетических трат. Важным является различие между двумя внутренними электронами, которые очень прочно связаны с ядром, и четырьмя внешними электронами, которое состоит в том, что последние удерживаются гораздо слабее. И когда рядом существуют другие атомы, именно эти четыре оказываются вожделенными целями для раздела. Слегка изменив свои орбитали, эти электроны могут существенно удаляться от «своего» ядра и пользоваться выгодами притяжения соседних. Атомы углерода в связках
Когда мы говорим о связанных состояниях атомов углерода, существует два особенно прекрасных, симметричных способа разделять электроны между атомами. Они показаны на илл. 27. Слева мы видим единицу структуры алмаза, которая демонстрирует идеальную трехмерную симметрию. Здесь четыре орбитали вытягиваются к вершинам тетраэдра – простейшего платонова многогранника, как вы помните. 
Илл. 27. Чистый углерод имеет две возможности установления связи между атомами, обе из которых оптимальны с точки зрения симметрии Справа мы видим единицу структуры графена, которая демонстрирует идеальную двумерную симметрию. Три лежащие в одной плоскости орбитали вытягиваются к вершинам равностороннего треугольника – простейшего правильного многоугольника. Белые шары в обоих случаях будут замещены другими атомами углерода с тем же типом связи, тогда как темные шары внесут вклад в слой квазисвободных электронов. (Строго говоря, плотность этого электронного слоя распределяется пополам – половина сверху и половина снизу по отношению к основной плоскости атомов углерода). Заметьте, что если каждая орбиталь занята одним электроном от каждого ядра, то мы отлично удовлетворяем принципу Паули, причем каждое ядро углерода делит по четыре своих электрона с соседними. На других иллюстрациях в этой главе вы увидите, как эти основные элементы комбинируются друг с другом и дают великолепное разнообразие материалов из чистого углерода. Не случайно именно эти особенно симметричные образцы связи атомов оказываются теми, которые соответствуют предпочтительной (низкой) энергии. Они позволяют реализовать мириады стабильных способов комбинировать атомы углерода, которые мы сейчас исследуем. Алмаз (трехмерная симметрия)
Структура алмаза на атомном уровне симметрична и гармонична (илл. 28). Каждое ядро атома углерода является центром четырех орбиталей электронов. Орбитали протянуты к четырем соседним ядрам, которые расположены в вершинах правильного тетраэдра. Такое расположение очень эффективно, поскольку электроны избегают друг друга, посещая два разных ядра. Электроны при такой расстановке счастливы и не желают ничего другого. Их трудно оторвать, и поэтому-то алмазы так трудно поцарапать! Чистые алмазы прозрачны в сущности по той же причине: фотоны видимого света не могут доставить достаточно энергии, чтобы заставить электрон изменить свое состояние. (Алмазы нечистые, где к углероду примешиваются некоторые другие элементы, или дефектные, с нарушениями кристаллической структуры, могут иметь цвет. Существует сложная система сортировки и оценки цветов ювелирных алмазов. Некоторые виды несовершенства оказываются лучше других или даже лучше самого совершенства…) 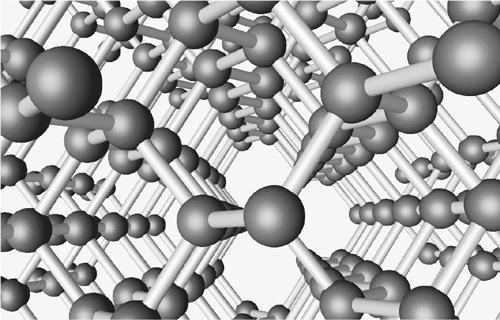
Илл. 28. Структура алмаза Каждое ядро углерода делит электроны с четырьмя другими в вершинах описанного тетраэдра. Это заполняющая пространство трехмерная структура 
Илл. 29. Структура графена Каждое ядро углерода делит электроны с тремя другими в вершинах равностороннего треугольника. В этой сотовой структуре, которая может распространяться бесконечно, мы узнаем одну из трех бесконечных платоновых поверхностей Графен (двумерная симметрия) и графит (2 + 1)
Самая стабильная форма элементарного углерода при комнатной температуре и нормальном давлении – это не алмаз, а графит. Вопреки своей широко разрекламированной репутации алмазы не вечны. Если пройдет достаточно много времени, они превращаются в графит (но пусть у вас не перехватывает дыхание). Графит – это черный материал, из которого делают грифели карандашей, а также широко используют как промышленную смазку. На атомном уровне графит – это сильно слоистый материал, состоящий из многих слоев графена (илл. 29), которые слабо связаны между собой. Слабость связи между слоями позволяет им легко скользить друг вдоль друга или сниматься. Это объясняет смазочные способности графита, а также способность оставлять штрихи на поверхностях. Мы говорим, что графит имеет 2 + 1 измерение, потому что его двумерные листы можно бесконечно укладывать друг на друга. Графен, однослойная версия графита, является простейшим и самым эффектным материалом этого рода. В течение десятилетий его изучали теоретически, прежде чем смогли получить в лаборатории. Поскольку графен так прост и правилен, квантовые физики-теоретики смогли с уверенностью и достаточно детально предсказать его свойства. Ожидалось, что графен будет чем-то феноменальным, если его смогут производить. Но можно ли его получить? Графен впервые был выделен Андре Геймом и Константином Новоселовым в 2004 г. В методе открытия было что-то от науки XIX в., каким-то образом перескочившее в век XXI. Они начали с карандашных штрихов, в которых обычно содержится несколько углеродных слоев, состоящих из графита. Потом ученые применили самоклеющуюся ленту, чтобы снять несколько слоев и перенести следы штрихов на тонкие предметные стекла. Эти следы составили нерегулярную поверхность, где были пятна, на которых углерод отсутствовал вообще, и те, где он сократился до одного слоя (графена!), а также пятна, где углерод имел толщину в два слоя и т. д. Различные слои показывали слегка отличающиеся цвета под поляризованным светом, поэтому Гейм и Новоселов смогли распознать пятна графена и изучить их свойства достаточно хорошо, чтобы доказать, что они и в самом деле являются пятнами новой модификации углерода – графена. В 2010 г. за эту работу Гейм и Новоселов получили Нобелевскую премию по физике. Графен имеет уникальные механические и электрические характеристики, которые сулят множество способов его применения. Вдохновленные этими перспективами люди уже нашли некоторые более эффективные способы получать его. Одно оптимистичное и, быть может, не столь уж сумасшедшее исследование предсказывает появление рынка графена объемом в 100 миллиардов долларов в следующие несколько лет.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно