
|
||
|
|
||
|
|
Онлайн книга - Самая главная молекула. От структуры ДНК к биомедицине XXI века | Автор книги - Максим Франк-Каменецкий
Cтраница 54

Однако многие эпидемиологи считают, что подобные принципиально новые вакцины пока вряд ли найдут широкое применение. Их скептицизм исходит из того, что такие вирусные заболевания, как гепатит и СПИД, наиболее широко распространены в развивающихся странах, где уровень здравоохранения недостаточен для восприятия этих слишком новых и сложных методов вакцинации. Они ссылаются на то, что наиболее крупный успех в искоренении вирусной болезни в мировом масштабе был достигнут при применении живой вакцины против оспы. Эта история, которой по праву гордятся эпидемиологи, началась очень давно, когда оспа еще свирепствовала в Европе. В 1798 году английский врач Эдвард Дженнер обратил внимание на то, что доярки, переболевшие легкой формой оспы, которой они заражались от коров, в дальнейшем уже не болеют оспой. Он стал нарочно заражать здоровых людей коровьей оспой и таким образом защищать их от настоящей оспы. Так было положено начало вакцинации (само слово «вакцина» по-латыни означает «коровий»). Много позже, когда благодаря изобретению Дженнера оспа была уже практически искоренена в Европе, выяснилось, что оба типа оспы вызывают вирусы. Они хотя и разные, но родственные. Некоторые белки, расположенные на поверхности коровьего вируса, названного вирусом осповакцины, идентичны поверхностным белкам вируса оспы. Поэтому иммунная система, приведенная в состояние боевой готовности после вакцинации, т. е. прививки вируса осповакцины, отлично защищает и от вируса оспы. Вирус осповакцины оказался уникальной находкой для эпидемиологов. Он практически безвреден для человека, очень эффективен при иммунизации и легко размножается при заражении им коров. Все это позволило Всемирной организации здравоохранения (ВОЗ) провести широкую многолетнюю кампанию по борьбе с оспой, которая увенчалась блестящим успехом. В 1977 году ВОЗ объявила, что этой болезни, которая еще недавно уносила миллионы жизней, на Земле больше нет. Б. Мосс и его сотрудники из Национального института здравоохранения (США) решили, используя методы генной инженерии, изменить вирус осповакцины таким образом, чтобы вакцинация защищала не только от оспы, но и от гепатита. Они встроили ген поверхностного белка вируса гепатита в ДНК вируса осповакцины, снабдив его эффективным промотором. Опыты на кроликах показали, что белок гепатита вырабатывается при вакцинации таким вирусом, причем в ответ на выработку этого белка в крови появляется множество антител против вируса гепатита. Метод Мосса позволяет создавать вакцины против разных вирусных заболеваний животных и человека на основе вируса осповакцины путем встраивания в ДНК вируса генов соответствующих поверхностных белков. Это очень многообещающее направление генно-инженерной эпидемиологии развивается весьма успешно в разных странах. При этом не надо заново учить медперсонал – ему приходится иметь дело с хорошо знакомым вирусом осповакцины. А если будет реализована идея Мосса, одним махом удается убить сразу нескольких зайцев, т. е. покончить одновременно с несколькими вирусными болезнями. Технология редактирования генома
Как я уже много раз отмечал, решающим событием, приведшем к рождению генной инженерии и вообще современной биотехнологической индустрии, было открытие ферментов рестриктаз. Рестриктазы узнают специальные последовательности в двуспиральной ДНК и наносят двунитевой разрыв в совершенно определенном месте (см. главу 4). Но рестриктазы узнают короткие последовательности, в основном состоящие всего из шести нуклеотидов, так что каждая конкретная рестриктаза нарезает геномную ДНК на множество фрагментов. Такой инструмент не годится для редактирования генома, т. е. для локального изменения текста, которое не затрагивало бы другие участки. Для этого нужен инструмент, способный с хирургической точностью сделать во всей геномной ДНК человека один разрыв. Давайте оценим, последовательность какой длины такой инструмент должен узнавать. Будем считать для простоты, что геномная ДНК представляет собой чисто случайную последовательность четырех нуклеотидов А, Т, Г, Ц, причем все четыре нуклеотида встречаются с одинаковой вероятностью (это, конечно, грубое предположение, но для приблизительной оценки вполне годится). Тогда вероятность встретить конкретную последовательность из n нуклеотидов будет, очевидно, 4—n. Такая последовательность встретится в геноме, состоящем из N нуклеотидов, N 4—n раз. Следовательно, чтобы последовательность встретилась всего один раз, нужно, чтобы выполнялось условие: N 4—n = 1. Из этого уравнения легко находим: n = logN / log4 – и, вспомнив, что человеческий геном состоит из 3109 нуклеотидов, получаем для n значение 16. Таким образом, для того, чтобы последовательность не повторялась в геноме, т. е. была уникальной, она должна состоять не менее чем из 16 нуклеотидов. Теперь мы видим, насколько рестриктазы – негодный инструмент для редактирования генома. Химики, биохимики и биофизики взялись за поиск адекватного инструмента, в частности, автор этих строк приложил большие усилия в этом направлении. Первой идеей было использовать способность ДНК образовывать тройную спираль, о чем мы уже говорили в главе 9. Идея казалась очень привлекательной. Достаточно выбрать целевую последовательность в геноме из, скажем, 16 нуклеотидов и синтезировать соответствующую цепь однонитевой ДНК из 16 нуклеотидов, которая образовывала бы с выбранным участком геномной ДНК тройную спираль. На один из концов синтетической ДНК можно приладить активную химическую группу или даже целый белок-эндонуклеазу, способный разрезать ДНК там, куда он доставлен. Но проблема с триплексами в том, что они образуются только в тех местах генома, в которых в одной цепи стоят одни пурины (А и Г), а, соответственно, в комплементарной цепи одни пиримидины (Т и Ц). Такие участки длиной в 16 или более нуклеотидов редко встречаются в геноме, что резко сужает выбор целевых участков для разрезания. Так что от ДНКовых триплексов пришлось отказаться. Следующей идеей было использовать синтетический аналог ДНК, ПНК, или пептидную нуклеиновую кислоту. Этот очень интересный синтетический аналог ДНК был изобретен в 1991 году в группе Питера Нильсена в университете Копенгагена. ПНК имеет те же основания, что и ДНК, но вместо сахарофосфатного остова основания присоединены к пептидному остову, похожему на остов белковой цепи (рис. 45). Поскольку, в отличие от ДНК, ПНК не несет отрицательного заряда, две молекулы ПНК образуют с одиночной цепью ДНК очень прочные триплексы. Эти триплексы настолько прочные, что две молекулы ПНК в определенных условиях способны раскрыть двойную спираль, образовав триплекс с одной из цепей, оставив комплементарную цепь без партнера (рис. 45). У ПНК множество применений, но нас сейчас интересует одно из них, состоящее в превращении обычных рестриктаз, узнающих последовательности из шести нуклеотидов, в инструмент с гораздо большей избирательностью. Как это делается, схематически показано на рис. 45. 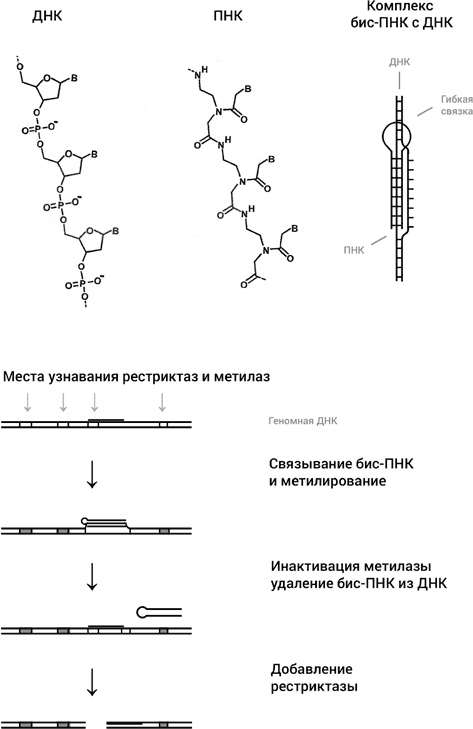
Рис. 45. ПНК имеет те же основания, что и ДНК (обозначены как В), но они прикреплены к совсем другому остову, чем в ДНК, напоминающему остов молекулы белка. Так называемая бис-ПНК, состоящая из двух коротких молекул ПНК, связанных гибкой молекулярной связкой, образует триплекс с одной из цепей ДНК (посредством триад, изображенных на рис. 42), оставляя комплементарную цепь в виде однонитевой петли. В нижней части рисунка дана схема того, как бис-ПНК используется для того, чтобы превратить обычную рестриктазу в очень редко расщепляющий ДНК инструмент
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно