
|
||
|
|
||
|
|
Онлайн книга - Мы - это наш мозг. От матки до Альцгеймера | Автор книги - Дик Свааб
Cтраница 62

Другая болезнь, при экспериментальном лечении которой применяют трансплантацию зародышевой ткани, это болезнь Хантингтона, наследственная болезнь расстройства движений, при которой отмирают мозговые клетки полосатого тела (стриатумс). В поздней стадии болезни наступает деменция. Сравнительно недавно возникшая мутация, ставшая причиной этой болезни, является настолько редкой, что все случаи заболевания в Южной Африке восходят к одному-единственному матросу, который в 1652 году на корабле Яна ван Рибеека прибыл на мыс Доброй Надежды. Первые трансплантации зародышевой ткани стриатума уже были проведены пациентам с болезнью Хантингтона и сопровождались клиническими улучшениями. В настоящее время проводятся многосторонние исследования. Изучение умерших пациентов показало, что трансплантат содержит живые клетки, интегрированные в сеть мозговых клеток реципиента. В одном случае трансплантат вырос настолько сильно, что это привело к неврологическим проблемам. Здесь также следует проявлять очень осторожный оптимизм. При глазных болезнях, при которых слепоту вызывает дегенерация нервных клеток, как при пигментном ретините (retinitis pigmentosa) или макулярной дегенерации, трансплантируют зародышевую сетчатку. Результаты обнадеживающие. Если трансплантация зародышевой мозговой ткани в будущем действительно окажется успешной и можно будет эффективно восстанавливать дефекты мозга, тогда возникает важный вопрос. Ведь в конце концов наш характер и многие наши качества закладываются в структуре нашего мозга в процессе развития плода. Какие свойства донора могут передаваться, если зародышевый материал его мозга трансплантируется в наш собственный мозг? Свойства должны зависеть от того, какой именно зародышевый ареал мозга трансплантируется и в какое место мозга реципиента. Очень трудно предсказать заранее, какие свойства могут при этом быть переданы. Если метод докажет свою эффективность и будет применяться на более высоких структурах мозга, таких как кора больших полушарий, можно будет задаться вопросом, не создаст ли это нового человека и какое количество трансплантата должно будет заставить реципиента взять в качестве второй фамилии фамилию донора. Будет особенно интересно, если удастся трансплантировать вещество мозга, взятое у другого вида. Поскольку доступность зародышевого материала мозга представляет собой большую проблему, больным паркинсонизмом уже трансплантировали зародышевую мозговую ткань свиней и затем с помощью медикаментов подавляли реакцию отторжения. Однако до сих пор безуспешно. Лишь немногие свиные клетки приживались в мозгу больных паркинсонизмом. Но если однажды такая ксенотрансплантация всё же удастся, передаст ли человеку трансплантат свиньи хоть малую толику ее дружелюбия и ума? ХII.7 Генная терапия
Кусочек ДНК как лекарство… При генной терапии в клетку вводят небольшие фрагменты ДНК, которые содержат код для определенного белка (ген). После этого клетка начинает вырабатывать новый генный продукт, белок, как лекарство. До недавнего времени полагали, что эта новая терапия, которая лишь в последнее время опробуется экспериментально в культурах клеток и на подопытных животных, еще очень далека от клинического применения при болезнях нервной системы. Но в офтальмологии и лечении болезни Альцгеймера генная терапия уже испытывается на пациентах. В последние годы группа Марка Тушинского в Сан-Диего впервые стала применять генную терапию при лечении болезни Альцгеймера. Исследователи заставили клетки производить фактор роста нервов (nerve growth factor, NGF) как возможное лекарство. Им воздействовали на одну из областей мозга, важную для памяти, базальное ядро Мейнерта (nucleus basalis Meynert, NBM, рис. 24). Клетки NBM находятся в основании мозга. Они отвечают за то, чтобы во всей коре мог вы-рабаг ываться химический нейротрансмиттер ацетилхолин. Это химическое вещество исключительно важно для памяти. Активность NBM-клеток с возрастом падает и при болезни Альцгеймера резко снижается. Тушинский впервые показал, что у старых макак-резус генная терапия с NGF может восстанавливать активность нейронов в базальном ядре Мейнерта (NBM). Для этого он сначала брал несколько клеток кожи, так называемые фибробласты, которые выращивал вне тела. Затем он вводил NGF-ген в эти клетки, после чего трансплантировал их в мозг старых макак в непосредственной близости к базальному ядру Мейнерта (NBM). Эти клетки кожи по меньшей мере год вырабатывали в теле макак-резус фактор роста нервов (NGF) и побуждали клетки базального ядра Мейнерта (NBM) к новой активности. 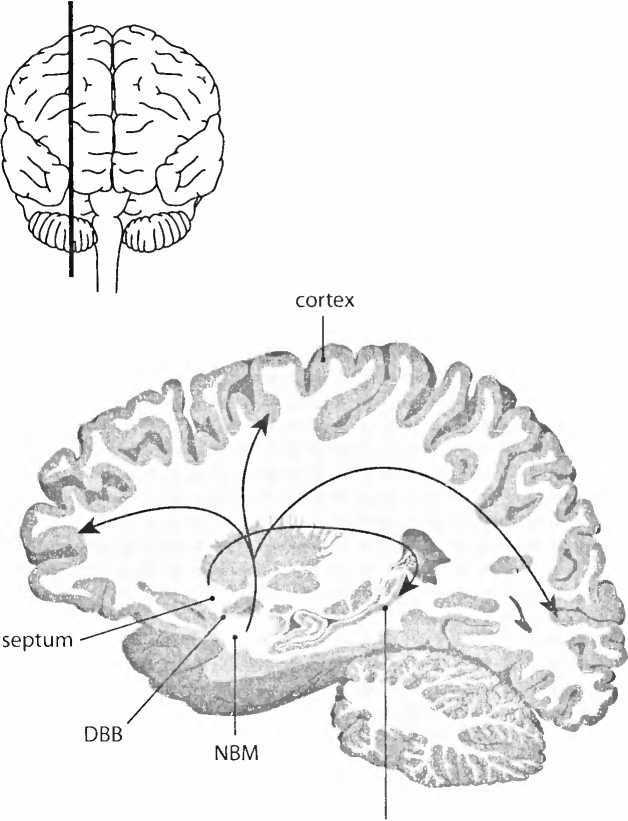
Рис. 24. Базальные ядра (базальное ядро Мейнерта, NBM; диагональная связка Брока, DBB; и септум) являются источником химического нейротрансмиттера ацетилхолина в коре больших полушарий и гиппокампе. Этот нейротрансмиттер очень важен для памяти (см. также рис. 32). При лечении болезни Альцгеймера следовали этой же процедуре. Для первой фазы отобрали восемь пациентов на ранней стадии болезни, так что они могли сами дать согласие на этот эксперимент и затем наблюдать за его проведением. В первой фазе исследования, направленной на то, чтобы протестировать переносимость новой терапии, выращивали культуру клеток кожи пациента вне тела. В эти фибробласты вводили NGF-ген. В качестве нейротрансмиттера использовали вирус. Вирус сделали настолько безвредным, что, хотя его вместе с NGF-геном внедряли в клетку, он не размножался и не мог стать причиной болезни. Клетки кожи, вырабатывающие NGF, посредством операции на мозге вводили вблизи базального ядра Мейнерта (NBM). Для этого применяется аппаратура, дающая возможность точно видеть, в каком месте мозга находится острие иглы, — стереотаксис, мозговой ТомТом (навигатор), как назвал его геронтолог Берт Кейзер. Операция у первых двух пациентов прошла далеко не оптимально. Она проводилась, как это обычно бывает при стереооперациях на головном мозге, без наркоза. Хотя пациенты получили успокаивающие лекарства, они не смогли оставаться неподвижными при инъекции клеток, что привело к мозговому кровотечению и одностороннему параличу. У одного пациента паралич прошел, другой пациент умер через пять месяцев от легочной эмболии и остановки сердца, то есть от осложнений, не связанных ни с операцией, ни с генной терапией. Другим пациентам клетки вводили при полном наркозе, и осложнений из-за подвижности не возникало. Томографические наблюдения показали, что кора после операции стала активней. Утверждают, что у пациентов с болезнью Альцгеймера после генной терапии ухудшение памяти развивалось вдвое медленнее, чем у больных, не подвергшихся такой операции. Но это была лишь первая фаза, то есть это не было хорошо проконтролированным исследованием. В мозге пациента, умершего через пять месяцев после операции, можно было констатировать сильное стимулирующее воздействие на NBM-нейроны. Это позволяет надеяться на реальный успех генной терапии. Нам остается ждать, какие результаты и побочные эффекты принесет эта терапия. Ранее в Швеции уже попытались трех пациентов с болезнью Альцгеймера лечить фактором роста нервов (NGF), который с помощью инфузионных шпри-цевых насосов вводили в желудочки мозга. Эти исследования, однако, пришлось прервать, так как NGF весьма незначительно влиял на функцию памяти, вызывая при этом побочные явления в виде хронических болей и потери веса. NGF, вырабатываемый клетками, которые Тушинский вводил в мозговую ткань, пусть лучше остается там, где он был, во избежание вышеуказанных осложнений. Мы установили, что у пациентов с болезнью Альцгеймера чувствительность к NGF в базальном ядре Мейнерта (NBM) резко увеличилась. Создаст ли это новые проблемы, пока не ясно. Следующий шаг, который наметил Тушинский, это с помощью другого вируса вводить NGF непосредственно в мозг, поскольку такой метод, вероятно, будет более эффективным.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно