
|
||
|
|
||
|
|
Онлайн книга - Мусорная ДНК. Путешествие в темную материю генома | Автор книги - Несса Кэри
Cтраница 73

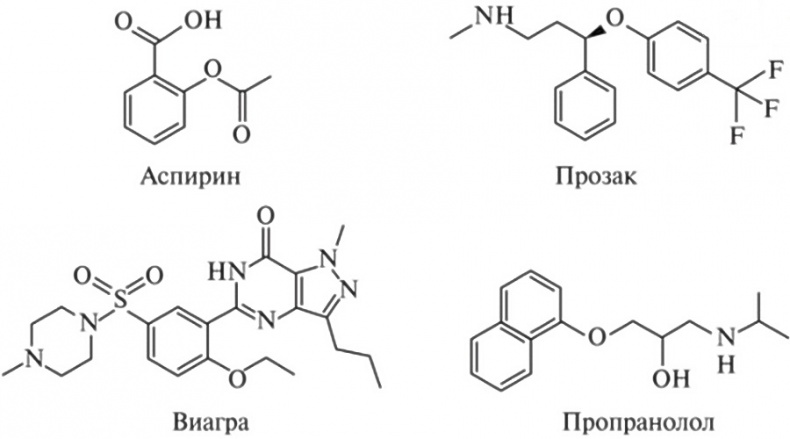
Рис. 19.1. Структурные формулы некоторых малых молекул, применяемых в медицине (под ними — названия лекарств, действующим началом которых они являются). Не так давно ученые научились использовать белки в качестве лекарств. Вероятно, наиболее известный пример — инсулин, тот самый гормон, посредством которого диабетики регулируют уровень сахара в крови. Антитела — еще один тип белковых средств, оказавшихся весьма эффективными. Речь идет об искусственно измененных версиях молекул, которые наш организм производит для борьбы с инфекциями. Фармацевтические компании находят способы адаптировать их так, чтобы эти вещества соединялись с белками, проявляющими сверхэкспрессию, и нейтрализовали их действие. Самое популярное из таких антител позволяет весьма эффективно лечить ревматоидный артрит. Есть и другие, помогающие при лечении самых разных болезней и дефектов — от рака груди до слепоты1. Малые молекулы и антитела имеют свои достоинства и недостатки. Синтез малых молекул обычно стоит недорого. Их легко вводить в организм: зачастую их нужно просто проглотить. Однако их недостаток в том, что они не задерживаются в организме очень уж надолго, и пациент вынужден принимать их регулярно. Антитела же могут оставаться в организме неделями или даже месяцами. Но их должен вводить профессионал, и они очень дороги в производстве. Имеются у таких средств и другие недостатки. Антитела эффективны лишь для борьбы с молекулами, которые присутствуют в телесных жидкостях (скажем, в крови) или на поверхности клеток. Эти лекарства не могут проникать внутрь клеток, чтобы выполнять там свою работу. А вот малые молекулы определенной структуры в случае необходимости это умеют. Но с их помощью, похоже, можно контролировать лишь ограниченное число разновидностей белков. Малые молекулы работают как ключ в замке. Если вы находитесь в своем доме, проще всего помешать другим войти, заперев дверь изнутри и оставив ключ в замочной скважине. А если вам захочется навеки закрыть всем доступ в дом, вы можете даже использовать слегка дефектный ключ, который навсегда застрянет в замке. Такой подход срабатывает, поскольку ключ входит в замок весьма плотно. А вот для блокировки какого-нибудь старомодного засова ключ бесполезен. Ему там просто не во что войти. Он будет лишь скользить по поверхности. То же самое относится и к нашим клеткам. Внутри у них имеется множество белков, которые мы и рады бы контролировать, только вот не можем создать для них подходящие малые молекулы — из-за структуры этих белков. В них попросту нет удобных щелей или карманов, куда можно было бы аккуратно вставить молекулу лекарства. У них обширные плоские поверхности, на которых негде приютиться малой молекуле. Можно попытаться создать более крупные молекулы, способные покрыть всю такую поверхность. Проблема в том, что как только молекулы лекарства превысят определенный размер, они перестанут хорошо циркулировать в организме и вообще не смогут попасть в клетки, чтобы сделать свое дело. Есть и еще одна проблема. Да, достаточно трудно создать лекарство, молекулы которого сумеют попасть в клетку, соединиться с определенным белком и остановить его работу. Однако неизмеримо труднее создать лекарство, молекулы которого сумеют попасть в клетку, соединиться с определенным белком и затем вынудить его работать интенсивнее, или быстрее, или лучше. Практически невозможно разработать лекарство традиционного типа, которое усиливало бы экспрессию одного определенного белка или включало бы лишь один-единственный ген. Может ли нас спасти мусорная ДНК?
Вот почему поиск новых подходов к медикаментозному лечению вызывает такой большой интерес. Вот почему так важно все больше узнавать о мусорной ДНК. Используя длинные некодирующие РНК или малые РНК, теоретически возможно избирательно воздействовать на биологические пути, на которые нельзя повлиять с помощью традиционных препаратов, где основой служат малые молекулы или антитела. И неважно, что мишени воздействия таятся внутри клеток и имеют обширные плоские поверхности. Неважно, что нам понадобится — усиливать экспрессию или менять особенности функционирования белка или гена. Можно применить этот новый подход для работы с любым типом клеточных мишеней. Теоретически. В том-то и дело. Теоретически. Идеи встречаются часто, а вот их успешное воплощение — куда реже. Так что имеет смысл хорошенько разобраться в реальном положении вещей, прежде чем все мы начнем вкладывать свои сбережения в какую-нибудь новомодную биотехнологическую компанию, орудующую в этой сфере. Уже сейчас здесь происходит очень много всего2, поэтому сосредоточимся на некоторых наиболее выдающихся примерах. Печень вырабатывает белок, отвечающий за распространение по организму ряда других молекул. Во всем мире живет около 50 тысяч человек, унаследовавших мутацию гена, кодирующего этот белок. Собственно, встречается масса разновидностей такой мутации, но все они, судя по всему, дают схожий эффект — изменяют особенности функционирования белка, да так, что он начинает служить переносчиком не тех молекул [74],3. Когда такое происходит, в тканях постепенно скапливаются отложения, состоящие из смеси нормального и мутантного белка. Больные страдают от целого ряда симптомов — в зависимости от того, какие ткани затронуты. Примерно в 80% известных случаев сильнее всего затронуто сердце, что приводит к потенциально летальным сердечным дефектам. В остальных 20% случаев отложения часто скапливаются в нервах и спинном мозге. Это может приводить к нарушению функционирования самых разных органов — в частности, к возникновению аномальных и болезненных реакций на слабые раздражители. Компания Alnylam создала на основе малой РНК, прикрепленной к молекулам из группы сахаров, средство, которое можно вводить пациентам при помощи инъекций. Малая РНК связывается с нетранслируемой областью на конце информационной РНК, кодирующей белок, который мутирует при данном заболевании. Это обрекает данную информационную РНК на уничтожение. В 2013 году компания обнародовала сведения о второй стадии клинических испытаний своего препарата. После введения средства у пациентов наблюдалось резкое падение уровня циркуляции мутантной и нормальной версий белка, причем этот пониженный уровень долгое время оставался неизменным4. Обнадеживает. Но пока нельзя считать, что новое средство исцеляет от данной болезни. Есть предположения, что такое резкое снижение уровня циркуляции белка приведет к тому, что отложения в тканях будут накапливаться медленнее, что должно привести по крайней мере к замедлению развития заболевания. Но мы пока не знаем, так ли это на самом деле. Требуются более масштабные испытания, в ходе которых будут отслеживаться реальные симптомы и реальное развитие болезни. Только если окажется, что новое лекарство влияет и на то, и на другое, препарат можно будет считать эффективным.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно