
|
||
|
|
||
|
|
Онлайн книга - Мусорная ДНК. Путешествие в темную материю генома | Автор книги - Несса Кэри
Cтраница 67

Манипулирование сплайсингом в лечебных целях
Как мы видели в главе 7, при мышечной дистрофии Дюшенна, заболевании, быстро истощающем мышцы и переносимом в X-хромосоме, мутирует ген, кодирующий белок дистрофин. Этот ген имеет необычайно большие размеры — почти 2,5 миллиона пар нуклеотидных оснований. В нем около 80 участков, кодирующих аминокислоты. Эти участки должны положенным образом проходить сплайсинг и процессинг. Особенно важно это из-за того, что дистрофин — белок долгоживущий, а значит, любое изменение, которое повышает вероятность его неверного сплайсинга, будет влиять на клетку в течение длительного времени. Но наличие 78 интронов в этом массивном гене означает, что для него высок риск как спонтанных, так и наследуемых мутаций, способных влиять на сплайсинг. Почему? Просто из-за того, что сама немалая величина гена и большое количество в нем промежуточных областей создают для таких мутаций массу возможностей: попросту говоря, есть масса мест, где могут происходить мутации. В одном обзоре это описано довольно ярко и при этом информативно: «Массивный ген дистрофина (2,4 Мб), основную часть которого составляют его 78 интронов, так и напрашивается на неприятности со сплайсингом, которые и происходят у одного младенца из каждых 3 тысяч, рождающихся живыми»20. Итак, в некоторых случаях причиной мышечной дистрофии Дюшенна становятся погрешности сплайсинга. Однако часто это заболевание вызвано попросту отсутствием важнейших областей гена, а значит, и молекул белка, в нем закодированного. Впрочем, в последние годы забрезжила надежда на создание эффективных методик лечения этого пока неизменно летального недуга. Как ни странно, речь идет о разработке препаратов, способствующих аномальному сплайсингу дистрофинового гена у мальчиков с этим заболеванием. Белок дистрофин действует в клетках мышечной ткани как своего рода амортизатор. Его молекулы можно представить себе как пружины матраса. Чтобы матрас поддерживал тело, пружины нужно прикрепить к его верхней и нижней части. Если вследствие производственного брака в пружине нет последних 10 сантиметров, ее не удастся прикрепить к верхней половине матраса. Чем чаще вы будете пользоваться таким матрасом, там хуже он будет поддерживать ваше тело и тем больше будет искажаться его внутренняя структура. Мышечную дистрофию Дюшенна довольно часто вызывает потеря внутренних областей дистрофинового гена. Когда ген копируется в РНК, оставшиеся области в ходе сплайсинга остаются скрепленными вместе. Поэтому такой мутантный ген, в отличие от нормального, не обеспечивает появление некоторых аминокислот во внутренней части белка. Однако главную проблему вызывает не это (см. рис. 17.6). 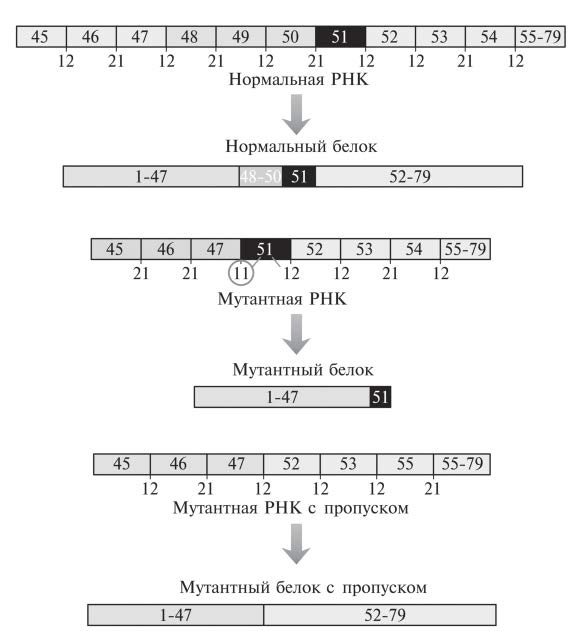
Рис. 17.6. Схематическое изображение ключевой области, где мутация в дистрофиновом гене может приводить к появлению существенно укороченной белковой молекулы из-за сдвига в системе аминокислотного считывания. Этот сдвиг (в данном случае) происходит, когда ДНК утрачивает кодирующие аминокислоты участки, обозначенные номерами 48-50. Чтобы поддерживать нужный характер считывания, каждое число, написанное под каждой границей участков, должно делиться на 3. Если добиться того, что в мутантном гене будет пропускаться при считывании и участок 51, нормальную последовательность считывания удастся восстановить. Для простоты все участки, кодирующие аминокислоты, показаны как прямоугольники одного размера, хотя на самом деле они отличаются по размерам. Как мы уже знаем, генетический код, задающий аминокислоты, считывается блоками по 3 нуклеотидных основания. Когда, как это происходит в нормальном гене, нужные участки, кодирующие аминокислоты (эти участки, если помните, называются экзонами), соединяются вместе, они порождают длинную молекулу информационной РНК, кодирующую множество аминокислот. Но если соединятся вместе не те экзоны, триплеты оснований перестанут читаться правильно. Вот вам простой пример: БЕЗ ВАС НАШ САД ТРИ ДНЯ БЫЛ ДЛЯ НИХ КАК ЛЕС Читая по три буквы, мы легко поймем смысл этой фразы. Но если одна буква выпадет, мы при таком же чтении по три буквы быстро начнем утрачивать и смысл: БЕЗ ВАН АШС АДТ РИД НЯБ ЫЛД ЛЯН ИХК АКЛ ЕС Это так называемый сдвиг рамки считывания. В информационной РНК такое явление первым делом приводит к тому, что в растущую белковую цепочку встраиваются неподходящие аминокислоты. Но вскоре происходит еще более резкое изменение. Встречается сочетание 3 букв, которое действует как стоп-сигнал. Рибосома тут же прекращает добавление аминокислот, и получается мутантный белок, длина которого меньше, чем у нормального. Это происходит у пациентов с делециями определенных областей дистрофинового гена. На рис. 17.6. рамка считывания триплетов обозначена номерами под прямоугольничками. Пока номера на границе соседних прямоугольников делятся на 3, рибосома может считывать информационную РНК. Но когда происходит наиболее распространенная при этом заболевании деления, это приводит к сдвигу рамки считывания, быстро порождая чтение стоп-сигнала и появление сильно укороченной белковой цепочки. Чтобы обойти эту проблему, можно попытаться, к примеру, заставить клетку «пропустить» один из участков, кодирующих аминокислоты и расположенных после места делении: это восстановило бы нормальный характер считывания. В результате появился бы белок с некоторой нехваткой аминокислот во внутренних частях, однако все равно способный неплохо функционировать. Это могло бы замедлить развитие симптомов. Используя аналогию с кроватными пружинами, мы схематически изобразили такой процесс на рис. 17.7. Молекула дистрофина сохранит способность соединить между собой нужные белки, находящиеся на противоположных ее концах. Конечно, она будет не таким хорошим амортизатором, как белок нормальной длины. Однако она будет работать куда лучше, чем белок, вообще не способный прикрепиться к нужным клеточным структурам. 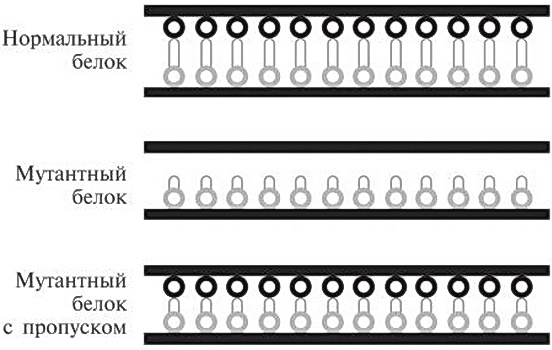
Рис. 17.7. Здесь схематически показан мутантный белок дистрофин, не способный прикрепляться к двум поверхностям клеточной мембраны. Версия мутантного белка, в которой пропущены некоторые внутренние аминокислотные последовательности, может прикрепляться к двум поверхностям мембраны. Она короче, поэтому служит не таким хорошим амортизатором, как нормальный белок, однако работает гораздо эффективнее, чем исходная мутантная версия. Свидетельства в пользу данной гипотезы выглядели убедительно, и биотехнологические компании запустили ряд проектов, дабы попытаться найти способ ее практического применения. Так, компания Prosensa разработала препарат, помогающий мышечным клеткам «пропускать» 51-й участок, кодирующий аминокислоты. Впоследствии она уступила права на этот препарат фармацевтическому гиганту GlaxoSmithKline. В апреле 2013 года GlaxoSmithKline опубликовал результаты испытания препарата на небольшой выборке, состоявшей из 53 мальчиков с подходящей формой дюшенновской мышечной дистрофии. Этих мальчиков случайным образом разделили на две группы. Одна группа получала экспериментальный препарат, другая проходила те же самые процедуры, но без него. Подобная проверка так называемым методом плацебо — очень полезный способ выявления эффектов лекарств, проходящих клинические испытания. Мальчиков обследовали через 24 недели и через 48 недель после начала эксперимента — определяли, сколько они смогут пройти за б минут.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно