
|
||
|
|
||
|
|
Онлайн книга - Мусорная ДНК. Путешествие в темную материю генома | Автор книги - Несса Кэри
Cтраница 41

Два наиболее известных примера — анемия Даймонда-Блекфена и синдром Тричера Коллинза. Их причиной служат наследуемые мутации двух разных генов, кодирующих белки. Следствие такой мутации в обоих случаях — уменьшение количества рибосом. Номы еще не до конца понимаем, как именно это влияет на функционирование клеток. Ведь если единственный важный фактор — снижение числа рибосом, клинические последствия будут одинаковы в обоих случаях. Однако это не так. Главный симптом анемии Даймонда-Блекфена — нарушение процессов выработки красных кровяных телец. Основные симптомы при синдроме Тричера Коллинза — деформации головы и лица, приводящие к проблемам с дыханием, глотанием и слухом6. Поскольку нам требуется много рибосом, а значит, и много рРНК-генов, логично предположить, что нам нужно и много тРНК-генов, чтобы обеспечивать нас большим количеством молекул транспортной РНК для доставки аминокислот к рибосомам. В человеческом геноме около 500 тРНК-генов, распределенных почти по всем хромосомам7. Это дает такие же преимущества, как и наличие множества копий рРНК-генов. Возможно, между рРНК и импринтингом существует некое странное и интригующее перекрывание. Как уже говорилось в главе 10, среди больных синдромом Прадера-Вилли есть небольшое количество пациентов, у которых заболевание затрагивает лишь одну зону мусорной ДНК. Эта зона кодирует целый набор некодирующих РНК. Такие РНК называются малыми ядрышковыми РНК [32]. Эти некодирующие РНК мигрируют к области ядра, которая называется ядрышком и которая играет очень важную роль в биологии рибосом. Ядрышко — то место, где происходит сборка зрелых рибосом (см. рис. 11.3). 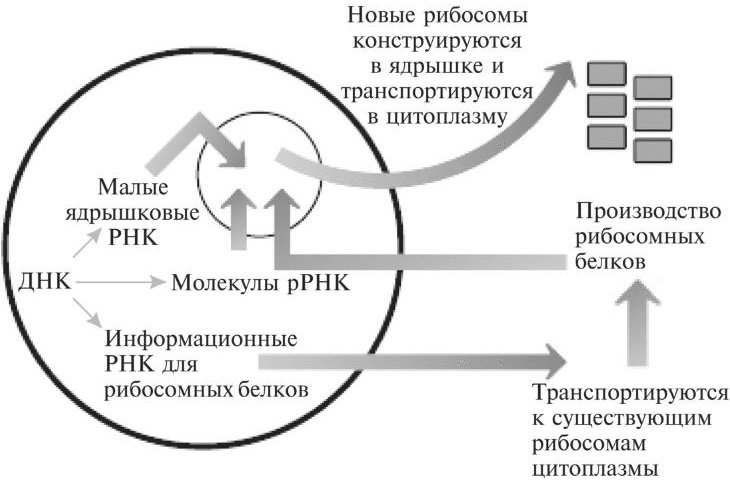
Рис. 11.3. Молекулы информационной РНК для рибосомных белков создаются в ядре и затем доставляются к существующим рибосомам цитоплазмы. Новые рибосомные белки переносятся обратно, в определенную область ядра. Там они соединяются с молекулами рибосомной РНК, создавая новые рибосомы, которые затем выводятся в цитоплазму, чтобы действовать в ней. В ядрышке эти рРНК и белки модифицируются. Затем из них в процессе сборки создаются зрелые «нетронутые» рибосомы, которые выводятся обратно в цитоплазму. Они готовы осуществлять свои функции роботов, создающих белки. Малые ядрышковые РНК требуются для того, чтобы определенные модификации должным образом происходили в молекулах рРНК. Подобно тому, как ДНК и гистоны можно модифицировать, пристраивая к ним метильную группу, молекулы рРНК также можно метилировать. Вероятно, малые ядрышковые РНК облегчают этот процесс, находя на рРНК участки, где могут образовывать нуклеотидные пары. Опять-таки, в основе этого — связывание соответствующих нуклеотидных оснований двух нуклеиновых молекул. После того, как соединение произошло, малые ядрышковые РНК привлекают ферменты, способствующие пристраиванию метильных групп к молекулам рРНК. Вероятно, это чем-то похоже на то, как длинные некодирующие РНК привлекают ферменты, модифицирующие гистоны [33]. Пока еще не вполне ясно, почему эти модификации важны для рРНК. Согласно одной из гипотез, они помогают стабилизировать взаимодействия между молекулами рРНК и рибосомными белками. Есть искушение предположить, что причиной симптомов, возникающих при синдроме Прадера-Вилли, как раз и является неправильный контроль рРНК-модификаций со стороны малых ядрышковых РНК. Но пока это лишь версия. Проблема в том, что теперь мы понимаем: малые ядрышковые РНК могут также таргетировать и многие другие типы молекул РНК. Поэтому нельзя с уверенностью сказать, в каком из процессов у больных детей происходят нарушения. Рибосомы — чрезвычайно древние образования. Их можно обнаружить в весьма примитивных организмах, к примеру, даже у бактерий — крошечных одноклеточных, в клетках которых нет ядра, а значит, ДНК у них не отделена от цитоплазмы. Специалисты по эволюционной биологии часто используют ДНК-последовательности генов, кодирующих различные рРНК, чтобы проследить, как отделялись друг от друга виды, со временем оказавшиеся на разных ветвях эволюционного древа. Бактерии отделились от более сложных организмов примерно 2 миллиарда лет назад8. Поэтому, хотя мы все-таки обнаруживаем рРНК-гены у этих наших одноклеточных родичей (очень дальних), эти гены сильно отличаются от наших. Оказывается, это очень хорошо! Некоторые из наиболее распространенных и наиболее успешно действующих антибиотиков работают благодаря ингибированию бактериальных рибосом9. В числе этих препаратов — тетрациклин и эритромицин. Они нарушают деятельность бактериальных рибосом, но не человеческих. Мы сегодня так привыкли использовать антибиотики, что подчас забываем, какую важную роль они сыграли в развитии медицины. Начиная с момента своего триумфального появления в 1940-е годы, антибиотики сохранили жизни миллионов людей. И многих из них удалось спасти благодаря тому, что у разных видов по-разному устроено то, что пуристы назвали бы мусорной ДНК. Не правда ли, забавно? Мы зависим от тех, кто нас захватил
Еще забавнее то, что каждый из нас колонизирован организмами, появившимися (в эволюционном смысле), вероятно, примерно тогда же, когда наши прародители отделились от предков современных бактерий. Собственно, «колонизирован» — это еще мягко сказано. И наше выживание, и выживание всех других многоклеточных на Земле, от травы до зебр, от китов до червей, в огромной мере зависит от этой колонизации. От нее зависит даже выживание дрожжей, тех самых, которые мы используем для приготовления хлеба и пива. Миллиарды лет назад в клетки наших самых первых предков вторглись крошечные организмы. На этой стадии, вероятно, не существовало организмов размером более 4 клеток, да и они, эти клетки, не отличались особой специализированностью. Вместо того, чтобы начать войну друг с другом, захваченные клетки и их микроскопические захватчики пришли к компромиссу, от которого выиграли обе стороны. Так завязалась прекрасная дружба, длящаяся уже миллиарды лет. Эти крошечные организмы постепенно превратились в важнейшие компоненты наших клеток — митохондрии. Они расположены в цитоплазме. По сути, эти субклеточные органеллы — миниатюрные генераторы, вырабатывающие энергию, которая требуется нашему организму для выполнения всех его стандартных функций. Именно митохондрии позволили нам использовать кислород для извлечения полезной энергии из пищевых продуктов. Без них мы оставались бы зловонными четырехклеточными ничтожествами, которым едва-едва хватало бы энергии хоть на что-то полезное. Почему мы так уверены, что митохондрии — потомки микроорганизмов, некогда живших отдельно от нас? Вот одна из причин такой уверенности: у митохондрий свой собственный геном. Он куда меньше, чем «настоящий» человеческий геном, хранящийся в ядре клетки. Его длина чуть больше 16 500 пар нуклеотидных оснований: сравните с 3 миллиардами пар оснований ядерного генома. В отличие от наших хромосом, митохондриальный геном уложен в кольцевую структуру. В нем лишь 37 генов. Примечательно, что более половины из них не кодируют белки. Двадцать два гена кодируют молекулы митохондриальной тРНК10, а два гена — молекулы митохондриальной рРНК. Это позволяет митохондриям производить рибосомы, которые затем используются для создания белков по инструкциям других генов митохондриальной ДНК [34]’11.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно