
|
||
|
|
||
|
|
Онлайн книга - Лестница жизни. Десять великих изобретений эволюции | Автор книги - Ник Лэйн
Cтраница 52

Когда Хаксли впервые сформулировал свою концепцию скользящих нитей, она была еще только гипотезой, основанной на довольно невнятных данных. Однако с тех пор, благодаря усовершенствованию тех же методов, которые теперь позволяют за доли секунды получать картины с атомарным разрешением, Хаксли и другим исследователям удалось доказать справедливость многих его предположений о точном молекулярном механизме мышечных сокращений. Там, где ученые викторианской эпохи могли наблюдать лишь довольно грубые микроскопические структуры, Хаксли удалось разглядеть тонкие молекулярные подробности и постулировать вероятный механизм. Теперь, хотя кое-какие неясности еще остаются, мы знаем, как именно сокращаются мышцы, с точностью почти до отдельных атомов. Сокращение мышц обусловлено свойствами двух веществ: актина и миозина. Оба они представлены многочисленными одинаковыми белковыми субъединицами, образующими длинные нити (полимеры). Толстые нити состоят из миозина, названного так еще в викторианскую эпоху, тонкие — из актина. Нити этих двух типов, толстые и тонкие, идут параллельно друг другу в пучках, где они соединены перпендикулярными мостиками (которые в 50-х годах Хаксли первым увидел в электронный микроскоп). Эти мостики не остаются неподвижными, а совершают взмахи — и с каждым взмахом немного сдвигают актиновые нити относительно миозиновых, как викинги, гребущие на своей ладье, подгоняя ее бег по волнам. Причем сходство с ладьей этим не ограничивается: взмахи весел здесь тоже не упорядочены и не подчиняются единому ритму. В электронный микроскоп можно увидеть, что из многих тысяч мостиков меньше половины движутся в унисон, а большинство “гребут” вразнобой. Однако расчеты показывают, что крошечные взмахи этих мостиков, даже машущих неслаженно, вместе дают достаточную силу, чтобы их работой полностью объяснялось сокращение мышц. Все эти машущие мостики торчат из толстых нитей и входят в состав миозиновых субъединиц. По молекулярным меркам молекулы миозина огромны — они в восемь раз больше, чем белки средних размеров, например гемоглобин. Каждая молекула миозина похожа по форме на сперматозоид — точнее, на два сперматозоида, головки которых торчат рядом, а хвосты переплетены так, что не развести. Каждая толстая нить состоит из ступенчато расположенных молекул, переплетенных в ней, как волокна в канате. Из этого каната во все стороны равномерно торчат головки. Они-то и образуют машущие мостики, взаимодействующие с актиновыми нитями. Миозиновые мостики работают так. Мостик связывается с актиновой нитью, а прикрепившись к ней, связывается с молекулой АТФ, которая обеспечивает весь процесс энергией. Сразу после этого мостик отделяется от актиновой нити. Теперь, освободившись, он совершает взмах (вокруг гибкого участка - “шейки”), описывая угол около 70°, а затем вновь связывается с актиновой нитью. Когда это происходит, остатки использованной молекулы АТФ высвобождаются, и мостик упруго возвращается в исходное положение, при этом работая как рычаг и протягивая тонкую нить вдоль толстой. Весь цикл (отделение, взмах, связывание, протягивание) действительно аналогичен работе весла, и каждый его повтор продвигает тонкую нить вдоль толстой на несколько миллионных долей миллиметра. Молекула АТФ играет здесь ключевую роль. Без нее головка не может отделиться от актина и совершить взмах, и мышцы коченеют, как это и происходит, например, при трупном окоченении, возникающем из-за отсутствия притока АТФ. (Где-то через сутки после смерти трупное окоченение начинает ослабевать из-за разложения мышечной ткани.)
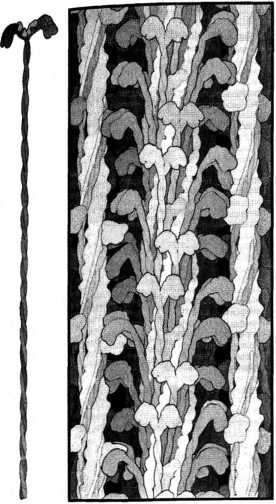
Акварельные рисунки Дэвида Гудселла, изображающие миозин. Слева: отдельная молекула миозина с двумя головками вверху, от которых отходят два сплетенных друг с другом хвоста. Справа: плотная миозиновая нить, образованная переплетенными, как волокна в канате, хвостами, из которой во все стороны торчат головки, взаимодействующие с актином. Существует множество разновидностей миозиновых мостиков. Они в целом похожи друг на друга, но различаются скоростью работы. Вместе они составляют большое “надсемейство”, включающее тысячи членов. Лишь у людей имеется около сорока разновидностей таких мостиков. Скорость и сила мышечных сокращений зависят от скорости работы миозина: быстрые молекулы миозина быстро расщепляют молекулы АТФ и осуществляют цикл сокращения, медленные молекулы — медленно. В каждом организме есть мышцы нескольких типов, и каждому из них свойственны своя разновидность миозина и своя скорость сокращения4. Подобные различия отмечаются и между видами. Самые быстрые миозины — в летательных мышцах насекомых, таких как плодовая мушка дрозофила. Циклы их работы совершаются с частотой несколько сотен раз в секунду — почти на порядок выше, чем у большинства млекопитающих. У маленьких животных, как правило, более быстрые миозины, так что мышиные мышцы сокращаются примерно втрое быстрее, чем человеческие, а крысиные — вдвое быстрее. Самые медленные миозины работают в исключительно медлительных мышцах ленивцев и сухопутных черепах. Их миозины расщепляют АТФ со скоростью раз в двадцать медленнее, чем человеческие. Хотя скорость сокращения наших мышц диктуется скоростью расщепления миозином АТФ, они устают вовсе не оттого, что в них заканчивается АТФ. Если бы это было так, после занятий в спортзале у нас всегда наступало бы окоченение, похожее на трупное, и нас приходилось бы разносить по домам на носилках. Утомление мышц наступает задолго до того, как весь АТФ в них может израсходоваться. Считается, что этот механизм выработался как адаптация, оберегающая нас от окоченения. Начало и конец мышечных сокращений определяются уровнем кальция в клетках. Именно это и связывает сокращение мышц с “животным электричеством” Гальвани. Когда к мышце приходит возбуждающий импульс, он быстро распространяется по сети внутриклеточных трубочек, из которых в клетку поступают ионы кальция. Запуская каскад реакций, которые мы не станем здесь разбирать, кальций вызывает обнажение тех участков актиновых нитей, с которыми связываются миозиновые мостики, и это позволяет мышце сокращаться. Но как только мышечная клетка наполняется кальцием, каналы, по которым он поступает, закрываются и запускаются насосы, закачивающие кальций обратно во внутриклеточные трубочки, где он будет ждать нового сигнала, чтобы запустить следующий цикл сокращения. Когда уровень кальция падает, связывающиеся с миозином участки актиновых нитей снова оказываются закрытыми, мостики больше не могут к ним присоединяться, и сокращения не происходит. После этого естественная упругость саркомеров обеспечивает их скорое возвращение в исходное расслабленное состояние. Разумеется, это очень упрощенное описание. Загляните в любой учебник, и вы найдете не одну страницу с изложением этих подробностей, где будут описаны белок за белком, каждый из которых играет свою собственную тонкую регуляторную или структурную роль. Биохимия мышц ужасно сложна, но сквозь нее просвечивает простота лежащего в ее основе механизма. Эта простота не только помогает понять суть процесса, но и имеет ключевое значение для эволюции сложных организмов. В различных тканях и у различных видов работает множество разных способов управления связыванием миозина с актином. Все эти биохимические детали сродни пышным украшениям барочной церкви, благодаря которым любая такая церковь может быть архитектурным шедевром, в то же время оставаясь одной из многих барочных церквей. И точно так же, несмотря на все пышные украшения, которыми отличаются разные варианты механизма работы мышц, миозин всегда связывается с актином, причем всегда в одном и том же месте, а АТФ всегда обеспечивает энергией скольжение одних нитей относительно других. |
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно