
|
||
|
|
||
|
|
Онлайн книга - Онтогенез. От клетки до человека | Автор книги - Джейми Дейвис
Cтраница 74

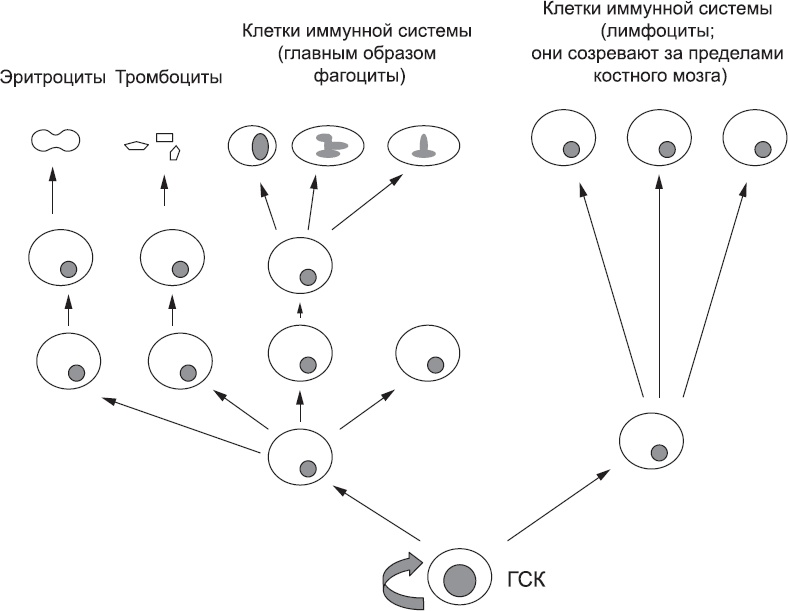
Рис. 84. «Генеалогическое древо» клеток, образующихся в костном мозге из гематопоэтических стволовых клеток (ГСК). Популяция этих стволовых клеток постоянно самоподдерживается и дает начало клеткам, расположенным выше на схеме. Эти клетки тоже размножаются, и поэтому каждое деление ГСК в нижней части «древа» приводит к образованию огромного количества терминально дифференцированных, зрелых клеток Хитроумные эксперименты с клетками костного мозга, выращенными в лабораторных условиях, позволили выявить множество сигнальных молекул, влияющих на скорость пролиферации клеток костного мозга. Каждый тип клеток реагирует на определенный набор сигналов. Клетки, которые уже приняли решение стать эритроцитами, несут на своих поверхностях рецепторы для гормона эритропоэтина. При низком содержании этого гормона клетки делятся очень неактивно – можно сказать, выжидают. Если эритропоэтина мало, клетки энергично пролиферируют, и их дочерние клетки превращаются в новые эритроциты. Сам эритропоэтин производится в основном в той части почки, где кровоснабжение по анатомическим причинам довольно скудно даже у здорового человека. Клетки почек «ощущают» концентрацию кислорода вокруг них, используя ту же молекулярную систему, что и клетки, «запрашивающие» новые кровеносные сосуды (глава 9). Чем ниже концентрация кислорода, тем больше эритропоэтина выделяют и высвобождают клетки почек. Этот эритропоэтин идет к костному мозгу, где стимулирует пролиферацию клеток и, следовательно, производство новых эритроцитов. В результате кровь переносит больше кислорода, и его содержание в тканях повышается. Чувствуя это, клетки почек сокращают производство эритропоэтина, и система приостанавливает свою работу, так что производство эритроцитов только балансирует потери и поддерживает оптимальное число этих клеток. Таким образом, система в целом самоорганизуется и производит ровно столько новых эритроцитов, сколько нужно. При этом ее отдельные компоненты не должны ничего «знать», а должны только правильно реагировать на простой химический сигнал. Этот механизм вполне надежен, если единственный источник эритропоэтина находится в здоровых тканях организма, но может нарушаться при болезненных состояниях, создающих ложные сигналы. Когда кровоснабжение почки снижается (например, при болезни или повреждении почечной артерии), клетки почки испытывают острую нехватку кислорода, в то время как остальные ткани организма находятся в полном порядке. Тогда клетки почек производят эритропоэтин в очень больших количествах, и новых эритроцитов производится слишком много. Аналогичным образом, если в организм вводят дополнительное количество эритропоэтина, костный мозг ведет себя так, как если бы количество эритроцитов достигло критически малого уровня, и производит новые клетки. Целый ряд спортивных скандалов последнего времени связан с тем, что спортсмены использовали эритропоэтин, чтобы увеличить кислородную емкость крови и, следовательно, максимальную мощность мышц. Производство клеток иммунной системы и их предшественников в костном мозге также регулируется сигналами организма. Например, под действием микробного заражения существующие защитные клетки – Т-клетки и фагоциты (глава 17) – производят сигнальные молекулы дальнего действия. Они распространяются через кровеносную систему по всему организму и достигают костного мозга, где стимулируют клетки вырабатывать «коктейль» локальных сигнальных молекул. Эти сигналы запускают пролиферацию клеток, уже вступивших на путь дифференцировки в клетки иммунной системы, а также активируют быстрое созревание клеток иммунной системы. Таким образом костный мозг реагирует на заражение в любом месте организма и быстро посылает туда подкрепление. Ситуационно зависимая стимуляция производства эритроцитов эритропоэтином и производства клеток иммунной системы другими сигналами решает проблему поддержания нужного количества клеток в кровеносной системе, но создает новую проблему в самом костном мозге. Популяция предшественников эритроцитов, пролиферация и созревание которых активируются эритропоэтином, не может самоподдерживаться бесконечно. Рано или поздно все клетки созреют и покинут костный мозг уже в качестве эритроцитов. Следовательно, им нужна замена за счет деления клеток, расположенных ниже на «генеалогическом древе» (рис. 84). Эти клетки тоже рано или поздно кончатся, и тогда придется делиться самим стволовым клеткам (ГСК). Это означает, что проблема контроля над пролиферацией охватывает все уровни «древа». Такое впечатление, что эта проблема решается с помощью относительно простого общего механизма сигнализации, который работает для всех клеток одинаково, хотя для разных типов клеток используются разные молекулы. [343] В принципе каждая клетка выделяет молекулы, которые ингибируют пролиферацию типа клеток, расположенного ниже на «генеалогическом древе». Если на высшем уровне достаточно клеток, вместе они будут производить достаточно ингибирующих сигналов, чтобы клетки под ними могли спать спокойно. Если количество клеток на более высоком уровне снижается из-за того, что клетки созревают и покидают костный мозг, то ингибирующих сигналов будет меньше, и поэтому клетки на более низких уровнях будут делиться более активно, а их дочерние клетки заполнят уровень над ними. Эта система ступенчато спускается вниз до уровня ГСК. В костном мозге явно есть и другие сигналы, но результаты компьютерного моделирования говорят о том, что эти нисходящие ингибирующие сигналы являются главными регуляторами пролиферации. Важность костного мозга как хранилища стволовых клеток крови была открыта уже несколько десятков лет назад, хотя многие детали работы этого хранилища все еще ждут своих исследователей. Одним из самых последних открытий является то, что стволовые клетки, расположенные в костном мозге, могут также давать начало клеткам других тканей организма. На самом деле, не исключено, что костный мозг способен производить клетки для поддержания любого типа соединительной ткани. Это открытие потрясает основы нашего понимания биологии человека. Эти стволовые клетки называются мезенхимными стволовыми клетками [344] и, видимо, являются дочерними клетками ГСК, о которых я только что говорил. Если удалить их из организма и выращивать в лабораторных условиях, мезенхимные стволовые клетки могут давать начало огромному спектру зрелых клеток, в том числе клеток соединительной ткани, жира, хрящей и костей. Разные условия культивирования приводят к получению разных типов клеток. Тот факт, что мезенхимные стволовые клетки из костного мозга могут производить те или иные типы клеток в лаборатории, не означает, что они на самом деле делают это в организме. Однако один непреднамеренный «эксперимент», поставленный непосредственно на людях, показал, что эти клетки действительно способствуют поддержанию удаленных соединительных тканей. Жизнь людей с разрушенным костным мозгом (например, под воздействием высоких доз радиации или агрессивной химиотерапии, применяемой против лейкемии) можно спасти, пересадив им здоровый костный мозг от донора. Если организмы донора и реципиента достаточно сходны и отторжения не происходит, донорские клетки поселяются в костном мозге реципиента и там начинают делать новую кровь. Совместимость донора и реципиента зависит в том числе от совместимости белков клеточной поверхности, которые производят их клетки. Это немного похоже на систему групп крови для донорства, только гораздо сложнее. Пол донора и реципиента не имеет значения, и нередко донор и реципиент являются братом и сестрой или отцом и дочерью.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно