
|
||
|
|
||
|
|
Онлайн книга - Цивилизация с нуля. Что нужно знать и уметь, чтобы выжить после всемирной катастрофы | Автор книги - Льюис Дартнелл
Cтраница 58

Диоксид углерода, необходимый для первого этапа процесса, получают, прокаливая известь (точно таким же способом, какой описан в главе 5 для обжига извести при производстве цемента и бетона). После того как из рассола экстрагируют соду, получившуюся при прокаливании негашеную известь добавляют в рассол. Она восстанавливает закачанный туда на первом этапе аммиак, который можно использовать вновь. Таким образом, производство соды методом Сольве расходует только поваренную соль и известь, а на выходе, кроме собственно соды, мы получаем попутный продукт — чистый хлористый кальций, который применяется как антиобледенитель на зимних дорогах. Эта изящная замкнутая система, где главный реагент, аммиак, раз за разом восстанавливается для повторного использования, строится на довольно простых химических операциях и до сих пор остается основной технологией производства соды во всем мире (кроме США, где в 1930-х гг. на территории штата Вайоминг открыли богатое месторождение троны — минерала, содержащего карбонат натрия). Для возрождающегося человечества метод Сольве открывает прекрасную возможность перескочить через неэффективные и экологически грязные методы производства насущно необходимой соды. Метод Сольве превращает легкодоступный элемент натрий (поваренную соль) в повседневно необходимое щелочное соединение — соду. Но развивающаяся цивилизация довольно скоро столкнется с нехваткой другого важнейшего материала. Один из самых нужных современному человеку химических процессов связан с азотом, и тут мы видим еще одно чудесное превращение бросового вещества в ценный сырьевой ресурс. 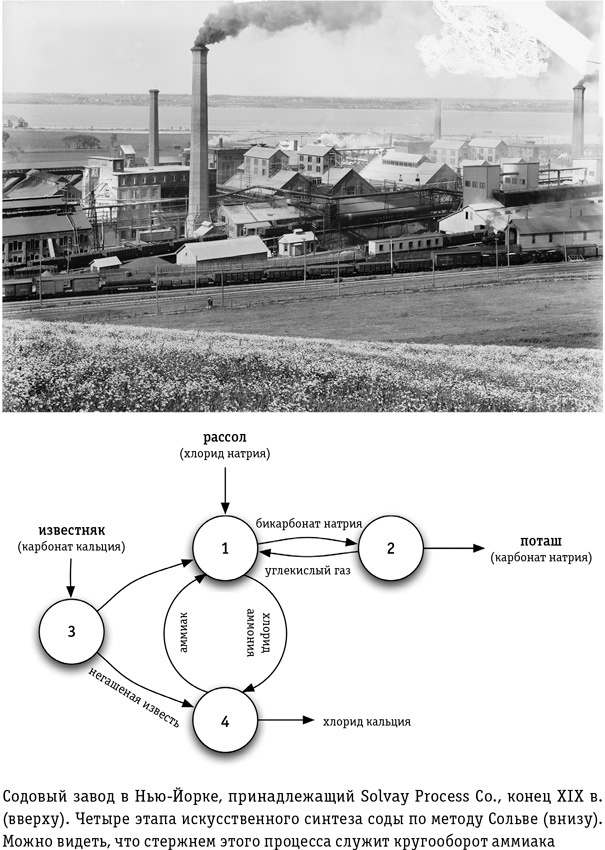
Если учесть, скольких людей она касается ежедневно, самой существенной технической новацией ХХ в. следует признать не воздушное сообщение, не антибиотики, не компьютеры и не атомную энергетику, а технологию получения простого и довольно неприятно пахнущего вещества — аммиака. Как мы не раз видели в этой книге, аммиак и родственные ему (и значит, химически взаимопревращаемые с ним) азотсодержащие соединения — азотная кислота и нитраты — это краеугольные камни химии, подпирающей цивилизацию. Без нитратов не обойтись в производстве удобрений и взрывчатки, но к концу XIX в. развитые страны стали испытывать дефицит этого ценного сырья. Спрос превысил предложение, и тогда американцам и европейцам пришлось крепко задуматься о том, чем вооружать армии и, хуже того, как обеспечить достаточно продовольствия, чтобы люди не страдали от голода. Тысячелетиями у человечества был только один рецепт: если население росло, раскорчевывали больше земли под пахоту. Однако, когда доступный запас земли уже освоен, прокормить растущее число едоков можно только за счет повышения урожайности культивируемых земель, и, как мы видели в главе 3, этому способствует внесение в почву навоза и выращивание бобовых культур. А если численность населения достигает определенной пороговой величины — когда, условно говоря, все стулья заняты, — цивилизация неизбежно заходит в тупик. Нет возможности получить больше навоза от скота, поскольку для этого нужны новые пастбища, сеять больше бобовых тоже нельзя, так как тогда сократятся поля под злаки. Потенциал органического земледелия исчерпан. Единственный выход — вносить в почву азот откуда-то извне, из-за пределов замкнутого сельскохозяйственного круга. На протяжении всего XIX в. сельское хозяйство Запада сильно зависело от привозного птичьего помета и селитры, добываемой в Чилийской пустыне. Но эти источники быстро истощились, и в 1898 г. председатель британской Ассоциации содействия наукам сэр Уильям Крукс предостерегал: «Мы одалживаемся из капитала Земли, но наши векселя не вечно будут принимать» (и нам сегодня стоило бы прислушаться к его словам, пока безудержный аппетит человечества к сырой нефти и другим природным ресурсам не истощил планету). В мире, остающемся после нас, уже не будет былых запасов природных нитратов, и взрослеющее постапокалиптическое общество упрется в эту стену довольно скоро. В земной атмосфере много азота — в каждом вашем вдохе этот газ составляет 80 % но при этом он упорно хранит химическую пассивность. Два атома азота плотно скреплены в пару тройной связью; вообще азот — самое инертное из всех двухатомных веществ, какие мы только знаем. Поэтому его совсем не просто преобразовать в удобную форму, «связать». К концу XIX в. стало ясно, что дальнейший прогресс цивилизации зависит от того, сумеет ли человек связать азот. Выручить человечество из беды предстояло химикам. Решение, найденное в 1909 г. и применяемое поныне, носит название процесса Гaбера — Боша. На первый неискушенный взгляд он кажется простым. Азот — самый распространенный газ в земной атмосфере, водород — самый распространенный химический элемент во Вселенной: два этих компонента смешивают в соотношении один к трем в реакторе, и они, соединяясь, образуют NH3 — аммиак. Азот можно просто закачивать из воздуха, а водород сегодня получают из метана, также его легко добыть электролизом воды. Чтобы побудить азот вступить в реакцию, нужно разорвать прочные связи, сцепляющие два атома в одно целое, а для этого требуется катализатор. Пористое железо с добавлением гидроксида калия (едкого кали, о котором мы рассказывали на с. 123, 127, хорошо помогает стимулировать реакцию. Эта реакция не доходит до завершения, поэтому газы охлаждают, чтобы нужный продукт конденсировался и выпал аммиачным дождем, который сливается в емкости, а еще не прореагировавшие газы снова запускаются в реактор, пока успешно не преобразуется почти весь объем. Но, как всегда, дьявол в деталях, и на самом деле процесс Габера — Боша осуществить довольно непросто. Многие химические реакции принципиально необратимы: поездка в один конец, во время которой реагенты перекомбинируются в новые вещества. Например, в горящей свече молекулы углеводородов воска в процессе горения окисляются до воды и углекислого газа, но обратная трансформация сама собой не произойдет никогда. Другие же химические процессы представляют собой обратимые реакции, в ходе которых два противоположных превращения происходят одновременно. «Реагенты» превращаются в «продукты», но в то же самое время последние вновь возвращаются в исходное состояние. Переход азотно-водородной смеси в аммиак — как раз один из таких обратимых процессов, и, чтобы склонить баланс в сторону нужного вещества, нужно тщательно задать условия в реакторе. Для получения аммиака это означает высокую температуру (около 450 °C) и мощное давление (около 200 атмосфер). Экстремальная среда в реакторе и трубопроводах и является причиной, по которой так непросто осуществлять процесс Габера — Боша. По сравнению с другими важными процессами, упомянутыми в этой книге и требующими использования горячих печей, например с выплавкой металла или изготовлением стекла, связывание азота — высокое достижение сложной инженерии. Если постапокалиптическому человечеству не удастся сохранить подходящий реакторный сосуд, придется научиться самим изготавливать промышленные термобарокамеры. Но вынудить азот соединиться с водородом и образовать аммиак — это лишь первый шаг. После того как азот связан, его нужно превратить в более широко употребляемую субстанцию — азотную кислоту. Аммиак окисляется в горячем конвертере — не в печи, а в сосуде, где, по сути дела, сам газообразный аммиак служит топливом и где имеется платиново-родиевый катализатор. Этот сплав содержится в каталитических нейтрализаторах, которые устанавливаются в выхлопных системах машин, чтобы уменьшить вредные выбросы, потому его сравнительно просто будет раздобыть. Получившийся диоксид азота затем абсорбируется водой, и получается азотная кислота.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно