
|
||
|
|
||
|
|
Онлайн книга - Лаборатория химических историй. От электрона до молекулярных машин | Автор книги - Михаил Левицкий
Cтраница 54

При сравнении двух вариантов таблицы, показанных выше, мы сразу понимаем, что вертикальные столбцы в первом варианте превратились в горизонтальные ряды во втором варианте – то есть Менделеев повернул таблицу на 90 градусов. И такое изображение сохранилось до наших дней. Важно то, что выведенный закон обладал предсказательной силой, что вскоре блестяще подтвердилось. Это был троекратный триумф – открытие предсказанных галлия, скандия и германия. В сравнении тем, что создал Менделеев, работа, которую проделали Майер и Ньюлендс, была по существу формальной классификацией элементов – авторы не нашли объединяющего закона и ничего не могли предсказать. Итак, в интервале 1864–1869 гг. трое ученых независимо друг от друга предложили три варианта систематизации химических элементов. По-видимому, необходимость таблицы "висела в воздухе". Вследствие широкого признания, которое получила работа Менделеева, в 1880 г. Майер опубликовал статью, где писал, что именно ему принадлежит приоритет в открытии закона. В итоге вопрос об истинном авторстве долгое время оставался открытым. Ситуация осложнялась тем, что в 1884 г. с претензиями на приоритетность выступил и Ньюлендс. В результате Лондонское королевское общество, чувствуя вину за прошлое свое ироничное отношение к его работе (предложение расположить элементы по алфавиту), присудило ему в 1887 г. золотую медаль им. Дэви – точно такую же, какую за пять лет до этого получили Менделеев и Мейер. Периодическая система по-разному повлияла на судьбу участников этой драмы. Майер потратил много сил, доказывая свое авторство, и в результате не оставил заметных научных трудов. То же самое можно было бы сказать и о Ньюлендсе, если бы не одна деталь. Именно он приписал химическим элементам порядковые номера. Эта простая процедура, как оказалось, имела очень важные последствия. В 1914 г. благодаря работам физиков А. ван ден Брука и Г. Мозли было установлено, что порядковый номер элемента в периодической системе точно соответствует заряду ядра и, соответственно, числу окружающих ядро электронов (поскольку атом электронейтрален). Началась новая жизнь периодической системы, связавшей строение атома и химические свойства элементов. Научная судьба Менделеева сложилась иначе, нежели у двух его предшественников. Заботы, связанные с доказательством своего авторства, не могли отвлечь столь крупного ученого от дальнейшей работы. Предсказав свойства не открытых еще элементов, он решил, что этим основная информация о периодической системе исчерпывается и просто надо набраться терпения и ждать, когда прогнозы подтвердятся. Он продолжает заниматься преподавательской и научной работой, а кроме того, выводит знаменитое уравнение состояния газов (уравнение Клапейрона – Менделеева, см. раздел "Разделить славу поровну"), вслед за тем работает над совершенствованием нефтеперерабатывающей и угледобывающей отраслей в России, формулирует принцип подземной газификации угля, возглавляет созданную Палату мер и весов, разрабатывает технологию производства бездымного пороха. Согласно легенде, Менделеев сумел разгадать состав пороха, производство которого было начато в Англии и Франции: он проанализировал сведения о том, какие продукты и в каких количествах завозятся по железной дороге на пороховые заводы. Всемирная слава, которая пришла к ученому после открытия трех предсказанных элементов, не отвлекла его от интенсивной работы. Любимое детище – учебник "Основы химии", который Менделеев многократно перерабатывал, – при его жизни издавался 8 раз. Этот классический труд и в наши дни привлекает читателей большим количеством неустаревших сведений, своеобразным нестандартным языком и явной любовью к излагаемому предмету. Лишь казус, о котором мы упомянули в начале рассказа, напоминает нам о давно ушедших в прошлое спорах об авторстве периодической системы. Скорее всего, по инерции западные издания таблицы копируют внешнее оформление, утвердившееся ранее. Тем не менее при изучении химии в школах большинства стран ученики узнают, кто истинный автор таблицы. На обратной стороне американского варианта, который показан на рис. 9.2, написано, что это "…модернизация периодической таблицы Менделеева". Существует также более весомое и убедительное признание заслуг Менделеева: в современной таблице элемент № 101 назван его именем – это единственный химик, упомянутый в ряду трансурановых элементов! И до, и после элемента 101 встречаются только имена физиков. Имена двух других ученых, претендовавших на право считаться первооткрывателями периодической системы, в этом ряду отсутствуют и, вероятнее всего, уже никогда не появятся. Химическая реакция – живое существо Если на живое существо оказывать внешнее неблагоприятное воздействие, оно отреагирует попыткой снизить влияние этого воздействия. Когда приходит холодное время года, птицы улетают в теплые края. Многие животные во время дождя прячутся под деревьями, в расщелинах скал или забираются в нору, чтобы не намокнуть. Антилопа, увидев подкрадывающегося тигра, старается убежать как можно быстрее. Если в помещении заметно похолодало, то мы постараемся надеть теплую одежду. Все это привычно и естественно. Необычно то, что подобным образом ведут себя многие химические реакции. Речь идет об очень крупной группе реакций, называемых равновесными. В них исходные продукты превращаются в конечные, а те, в свою очередь, могут превращаться в исходные: А + Б ⇄ C + D. В тот момент, когда скорости прямого и обратного процесса оказываются равны, возникает равновесие, и содержание всех веществ не изменяется. Подобное состояние возникает во многих реакциях, протекающих в газовой фазе и в растворе. Однако зачастую химиков это не устраивает – если нужно получить как можно больше конечных продуктов C и D, то равновесие необходимо сдвинуть. В решении проблемы помогает принцип Ле Шателье: если на реагирующую систему воздействовать определенным образом, то она сдвинется в том направлении, которое позволит снизить влияние этого воздействия (очень похоже на ответную реакцию живого существа). В химии существует три основных способа воздействия на реагирующую систему: а) понижение или повышение температуры; б) повышение или понижение давления; в) изменение концентрации одного из участников реакции. Третий способ самый очевидный и удобный. Если один из продуктов реакции, проходящей в растворе, выпадает в осадок, то его концентрация в реагирующей среде падает, и система старается восполнить его отсутствие. Соответственно, равновесие сдвигается в сторону образования уходящего из реакции (выпадающего в осадок) вещества. Приблизительно так же каждый из нас, замечая, что у него кончаются денежные средства, старается заработать еще. Вот пример равновесной реакции: смешаем растворы нитрата натрия (натриевая селитра) и хлорида калия: 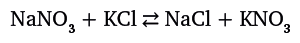
Все четыре вещества растворимы в воде, и никакого взаимодействия мы не увидим. Тем не менее сдвинуть равновесие вправо, то есть в сторону образования получающихся продуктов, все же возможно. Дело в том, что растворимость NaCl в воде почти не зависит от температуры, а растворимость KNO3 заметно зависит – при переходе от комнатной температуры к 100 оС она возрастает в 18 раз. Если мы смешаем горячие насыщенные растворы NaNO3 и KCl и охладим смесь, то начнут выпадать кристаллы калиевой селитры KNO3, которая очень плохо растворяется в холодной воде. В растворе концентрация KNO3 понизится, и равновесие сдвинется в сторону образования исчезающего из раствора вещества, то есть система постарается компенсировать возникшее нарушение равновесия. В конечном итоге в растворе останется почти чистый NaCl. Рассмотренная реакция в свое время сыграла заметную роль в развитии важного технологического процесса. До середины XIX в. черный (дымный) порох изготавливали смешением угля, серы и калиевой селитры, которую добывали из редкого и дорогого минерала – «индийской селитры». Запасы этого минерала быстро исчерпались. На смену пришли громадные запасы чилийской селитры – продукта тысячелетнего разложения птичьего помета, называемого гуано. Проблема состояла в том, что чилийская селитра содержала нитрат натрия NaNO3, который при хранении впитывает влагу воздуха, – зато этот недостаток отсутствует у KNO3. Рассмотренная выше реакция позволила решить проблему. И это согласуется с известной поговоркой «Держи порох сухим!».
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно