
|
||
|
|
||
|
|
Онлайн книга - Лаборатория химических историй. От электрона до молекулярных машин | Автор книги - Михаил Левицкий
Cтраница 24

Громадное количество светящихся существ (более тысячи видов) – среди обитателей морских глубин. Свечение моря волновало людей с незапамятных времен, вызывая не только изумление и восхищение, но и суеверный страх. Отсутствие научных знаний подводило человека к фантастическим объяснениям, отразившимся в мифах, легендах и сказках. Во многих случаях свечение морских обитателей – импульсное: они испускают короткие световые вспышки длительностью 0,1–1 с. Эти вспышки необходимы для отпугивания хищников или быстро движущихся животных, которые при случайном столкновении могут механически повредить нежный светящийся организм – такой как у медузы. У некоторых глубоководных рыб надо ртом имеется подвижный отросток – "удилище", а на нем – световая приманка для жертвы. Другие рыбы используют вспышки для освещения окружающего пространства. Удачный объект – половина успеха Вначале отметим, что живым организмам позволяют светиться принципиально различные процессы. Во-первых, это набор биохимических реакций с участием специальных ферментов (биокатализаторов). Такое свечение использует энергию химической реакции и может продолжаться до тех пор, пока не будут исчерпаны необходимые реагенты. Существует и иной механизм свечения: вещество поглощает из внешнего источника (например, дневное освещение) ультрафиолетовую часть спектра, которая обладает высокой энергией. В результате молекула переходит в возбужденное состояние, но может пребывать в нем очень недолго. Чтобы вернуться к "нормальному" состоянию, ей необходимо избавиться от излишка энергии, которую она получила с ультрафиолетовым облучением, что достигается излучением света, – это и есть флуоресцентный свет. Поскольку часть энергии была потрачена на переход молекулы в возбужденное состояние, испускаемый свет имеет бóльшую длину волны – сдвигается в сторону красной части спектра, что соответствует более низкой энергии. Общее правило флуоресценции – испускающийся свет всегда имеет бóльшую длину волны, нежели поглощенный. Итак, при флуоресценции не требуются какие-либо реакции с участием ферментов – нужна лишь ультрафиолетовая подсветка. Именно таким свойством, как оказалось, обладает зеленый флуоресцентный белок GFP, имеющийся у медузы эквореи – той самой, которую впервые описал П. Форскол. Этот белок при облучении ультрафиолетовым или синим светом дает голубовато-зеленое свечение. Осаму Симомура – первый из упомянутых нами лауреатов – сумел в 1962 г. выделить из организма медуз этот флуоресцентный белок GFP. 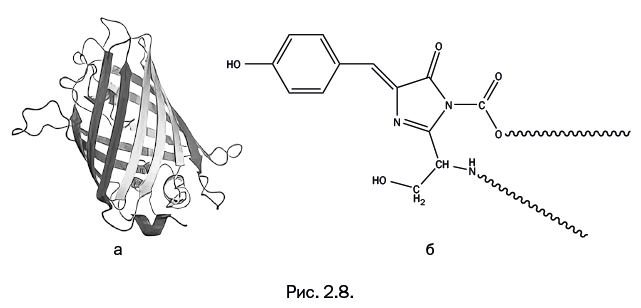
Структура GFP была расшифрована гораздо позже (в 1996 г.) в лаборатории Ремингтона. Молекула имеет форму, близкую к цилиндрической, образованную лентами белковых цепей. Внутри цилиндра расположена хромофорная (греч. χρωμοφόρου – «несущий свет») группа – она показана в виде конструкции из шариков. Эта группа химически связана с основной белковой молекулой (рис. 2.8, а – структура GFP; б – строение хромофорной группы). На первый взгляд кажется, что строение хромофорной группы достаточно сложное, и непонятно, как она возникает. На самом деле ее образование – результат трех весьма простых последовательных стадий: в результате каждой стадии в качестве побочного продукта выделяется вода. Все происходит внутри белкового цилиндра, показанного на рис. 2.8а. Биохимики давно знают, что внутри живого организма все белковые молекулы собираются из известных аминокислот. 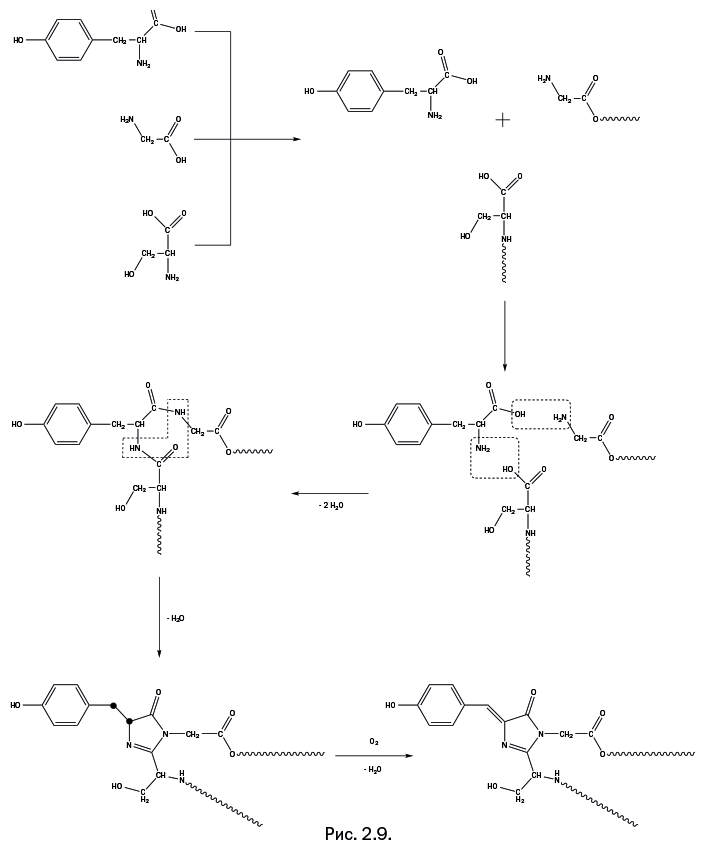
Кратко напомним, что такое аминокислоты. Это органические молекулы, содержащие аминогруппу H2N– и кислотную карбоксильную группу – СООН. Те аминокислоты, из которых собираются белки, имеют отличительный признак: между аминогруппой и карбоксильной группой находится всего один атом углерода. Общий вид всех природных аминокислот NH2-CR2-COOH. Органические заместители R у центрального атома углерода могут быть различными, в том числе и атомы водорода. При образовании белковых молекул концевая аминогруппа взаимодействует с концевой карбоксильной группой соседней молекулы с выделением воды: NH2-CR2-COOH + NH2-CR'2-COOH → NH2-CR2-CO-NH-CR'2-COOH Именно таким образом наращивается цепочка белковой молекулы. Кстати, при получении широко известных в быту полиамидов (например, нейлона) используют подобную простую реакцию: молекула с двумя аминогруппами на концах H2N-(CН2)n-NH2 взаимодействует с молекулой, имеющей две карбоксильные группы HCOO-(CН2)n-COOH (подробнее о полиамидах рассказано в главе «Империя длинных молекул»). Перейдем к образованию хромофорной группы в GFP. Она собирается из трех аминокислот: тирозина, глицина и серина (рис. 2.9), которые присутствуют в каждом живом организме. Три молекулы объединяются в единый реагирующий центр. Две аминокислоты из трех (глицин и серин) присутствуют не в виде свободных молекул, а в качестве "привесков" к внутренней полости основного цилиндра (на рис. 2.9 это показано с помощью волнистых линий). Далее все происходит точно таким же образом, как описано выше: карбоксильная группа тирозина реагирует с аминогруппой глицина, а аминогруппа тирозина взаимодействует с гидроксильной группой серина (реагирующие группы обведены штриховыми прямоугольниками), при этом выделяются две молекулы воды. Далее реагируют две аминогруппы и карбонильный кислород (обведены г-образным штриховым контуром), образуется пятичленный цикл, называемый имидазольным, с двумя атомами азота и двойной связью, и вновь выделяется молекула воды. На последней стадии молекула кислорода отрывает два атома водорода от двух атомов углерода, показанных на предпоследней стадии в виде утолщенных точек (рис. 2.9). Выделяется молекула воды, и в итоге образуется хромофорная группа. Несмотря на то что строение всей образовавшейся группы можно назвать достаточно сложным, реакции, ведущие к ее образованию, весьма просты, а исходные реагенты – хорошо известные природные аминокислоты. Показанный на рис. 2.8а белковый цилиндр не только служит "реакционной колбой" для получения хромофорной группы, но и защищает ее от случайных химических воздействий. Продолжение научной эстафеты В нашем рассказе появляется драматический поворот: настало время упомянуть имя ученого, без которого исследования могло и не быть. Тем не менее он не стал нобелевским лауреатом. Впрочем, все три лауреата в своих нобелевских докладах с глубоким уважением упомянули его имя. Первым, кто осознал возможности GFP, был американский биохимик Дуглас Прашер – ему пришла в голову интересная идея выделить ген ДНК, который обеспечивает в медузах синтез GFP, а затем ввести его в другие организмы. В результате такой организм начнет синтезировать белки с флуоресцирующим хвостом (своеобразным фонариком). Облучая объект ультрафиолетовым светом, можно будет заметить, где синтезируется и в какие участки клетки направляется белок с «зеленым фонариком» на конце.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно