
|
||
|
|
||
|
|
Онлайн книга - ДНК. История генетической революции | Автор книги - Кевин Дэвис , Эндрю Берри , Джеймс Д. Уотсон
Cтраница 134

Джон Даймонд, писатель и журналист 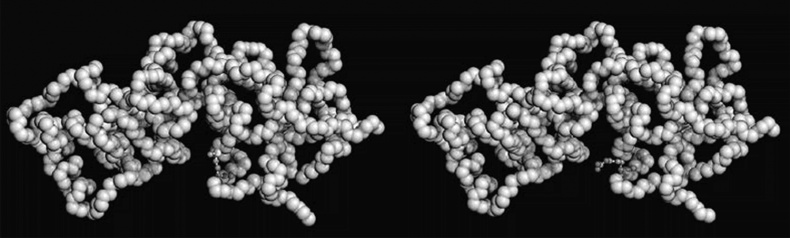
Точка слома: определенные мутации в гене BRCA1 коррелируют с развитием рака груди и яичников. Здесь показаны два снимка хвостового региона белка BRCA1. Слева выделена аминокислота метионин 1775, расположенная рядом со щелью, где BRCA1 связывается с другим белком, помогающим находить и чинить поврежденную ДНК. Справа в результате мутации подставляется остаток аргинина, который отключает такое «партнерское» свойство. Считается, что именно такая мутация M1775R вызывает рак груди Когда в 1997 году британскому журналисту Джону Даймонду (первому мужу знаменитого ресторанного критика Найджелы Лоусон) диагностировали рак пищевода, он стал вести в газете Times регулярную колонку о своей болезни. «Когда вам стукнет сорок, – писал он, – каждая из тридцати с чем-то триллионов ваших клеток успеет поделиться пару тысяч раз. Какова вероятность, что хотя бы некоторые из этих клеток не ударятся в цитологическую анархию, которая вызовет рак и погубит вас?» Даймонд, умерший в 2001 году, даже не будучи ученым, сделал проницательное естественнонаучное наблюдение. Действительно, малейшая ошибка в работе фермента, обеспечивающего рутинную химическую реакцию, мимолетное воздействие инородного химиката или случайный космический луч могут повредить спираль ДНК и спровоцировать необратимый и безудержный рост клеток. Скорее, удивительно не то, как много людей заболевает раком, а то, какому множеству удается этого избежать. Тот факт, что рак обусловлен, прежде всего или даже исключительно, генетическими изменениями, впервые был отмечен при исследовании семей, в которых прослеживались редкие заболевания, например синдром Линча. При таких расстройствах рак передается из поколения в поколение примерно как наследственное заболевание. Новые случаи рака ожидаемо возникают без какой-либо явной причины, например без участия известных естественных генетических канцерогенов, таких как табачный дым, сажа или асбест. Теперь известно, что многие или все такие семьи предрасположены к раку из-за ошибок в сложнейшей системе репарации нашей ДНК. В нашем геноме действительно есть копировальный механизм, в работе которого неизбежно возникают ошибки, но рак возникает, когда эта первая линия защиты нас подводит. К наиболее известным относятся случаи таких поломок, связанные с генами BRCA1 и BRCA2. (В главе 12 мы обсуждали, как Мэри-Клэр Кинг героически искала и наконец картировала ген BRCA1. Ее миссия растянулась на двадцать лет и легла в основу фильма «Расшифровка Энни Паркер», где в роли Кинг снялась Хелен Хант. Фильм рассказывает об одной из первых женщин в Северной Америке, прошедших генетический анализ на BRCA1.) У женщин мутации в этих генах провоцируют более половины всех известных случаев рака груди, а также большинство случаев наследственного рака яичников. У мужчин с мутацией в гене BRCA1 в шесть раз повышена частота рака простаты. Очень редко такая мутация (это подтвержденный факт) у мужчин тоже может вызвать рак молочной железы. Оба этих гена кодируют белки, которые играют ключевые роли в обеспечении целостности генома, корректируют несовпадения в парах оснований и проверяют последовательность на наличие неповрежденных, гомологичных нитей ДНК. Остается неясным, почему среди сотен зарегистрированных мутаций конкретные канцерогенные варианты генов BRCA1 и BRCA2 встречаются чаще среди евреев-ашкеназов или среди некоторых групп франкоканадцев. Идентификация генов BRCA1 и BRCA2 – две примечательные победы в долгой, затяжной войне с раком, но, как правило, исследователям вдобавок требуется превратить генетические находки в осмысленные методы лечения, дающие длительный терапевтический эффект. В декабре 1971 года, более сорока лет тому назад, президент Никсон объявил войну раку. С тех пор на эту войну ежегодно тратятся миллиарды долларов налогоплательщиков, но результаты борьбы неоднозначны. Негативная сторона проблемы такова: с тех пор как началась эта война, смертность от рака в США практически не уменьшилась, особенно если сделать поправку на то, что американцы стали значительно меньше курить. Есть такое заурядное кино про автоугонщиков с Николасом Кейджем в главной роли, называется «Угнать за 60 секунд». Именно каждые 60 секунд в США кто-нибудь умирает от рака. В 2016 году более 550 тысяч американцев умерли от злокачественных новообразований. 
Хелен Хант в роли Мэри Клэр-Кинг, картировавшей ген BRCA1, в фильме «Расшифровка Энни Паркер» (2013) Положительный аспект состоит в том, что сегодня мы располагаем несколькими новыми действенными средствами против рака. Лучшим противораковым лекарством уже более двадцати лет остается иматиниб. Он регулярно выводит на плато многолетней ремиссии пациентов с хроническим миелоидным лейкозом (ХМЛ). Еще один действенный препарат – герцептин, помогающий бороться с определенными формами метастатического рака молочной железы. Тем не менее большинство видов рака даже после ремиссии, достигаемой в том числе при при помощи геномных препаратов, впоследствии возвращается в гораздо более агрессивной форме, и тогда больному остается жить от нескольких месяцев до одного года. Поэтому, несмотря на все перспективы лекарств, используемых на сегодняшний день и действующих на генетическом уровне, онкологическое заболевание остается источником страха и мучений. Увы, так будет до тех пор, пока не разработают новые методы избирательного уничтожения раковых клеток, в том числе на поздних стадиях болезни. Этого можно добиться несколькими способами. Во-первых, разрабатывать новые мощные лекарства, блокирующие безусловно опасные канцерогенные вещества, например белки генов RAS и MYC. Сегодня они считаются двумя наиболее приоритетными мишенями, поскольку (как будет рассказано дальше) до сих пор не поддаются большинству современных терапевтических методов. Во-вторых, разрабатывать более качественные иммунотерапевтические лекарства, в частности нацеленные на взаимодействие с белками контрольной точки опухоли, «тормозами» иммунной системы. Иммунотерапия, то есть мобилизация иммунной системы пациента на борьбу с раковыми клетками, кажется очень многообещающей, но требует тонкой настройки, чтобы гарантировать, что иммунные клетки пациента станут бороться с раком, не причиняя чрезмерного сопутствующего вреда, который сейчас остается настоящим бичом при подобном лечении и сводит на нет самые перспективные виды хваленой иммунотерапии. В-третьих, нужно серьезно работать над проблемой побочных эффектов большинства химиотерапевтических препаратов, чтобы их можно было применять подолгу и достигать полноценного лечебного эффекта. В 2003 году Эндрю фон Эшенбах, в тот период руководивший Национальным институтом онкологии (NCI), поставил задачу «покончить с летальностью и мучениями от рака» к 2015 году. Естественно, эта цель была заведомо недостижима; позже он признал ошибку и уточнил, что имел в виду не победу над раком, а взятие болезни под контроль. Я долгие годы скептически высказываюсь на эту тему в статьях для New York Times и других изданий. Еще в августе 2009 года я заявил, что победа над раком – весьма «реалистичная цель, поскольку в кои-то веки мы знаем его подлинные генетические и химические свойства». После этого заключения пришлось взять тайм-аут. Такие программы, как «Атлас онкологического генома» (последовавшая за проектом «Геном человека»), дали нам массу информации о генетической природе рака, но более чем за десять лет, прошедших от этого заключения, так и не произвели желаемого эффекта в онкологии.
|

 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно