
|
||
|
|
||
|
|
Онлайн книга - Карнавал молекул | Автор книги - Михаил Левицкий
Cтраница 19

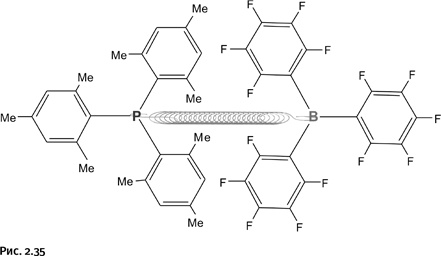
Такая борьба противоположностей не проходит бесследно; на атоме В сосредоточен положительный заряд, и бор находится в нетерпеливом ожидании донора электронов, а атом Р, наоборот, жаждет присоединить к себе что-либо, имеющее положительный заряд. При взаимодействии такого соединения с молекулярным водородом Н2 произошло нечто неожиданное. Молекулу Н2 можно считать эталоном ковалентной связи, однако находящиеся «в напряженном ожидании» ветвистые молекулы разрывают связь Н – Н, но не ковалентно (т. е. оставив по одному электрону каждому атому Н), а на ионы Н+ и Н–, почти так же, как вода «растаскивает» NaCl на Na+ и Cl–. В итоге Н+ притягивается атомом фосфора, Н– направляется к бору (рис. 2.36). 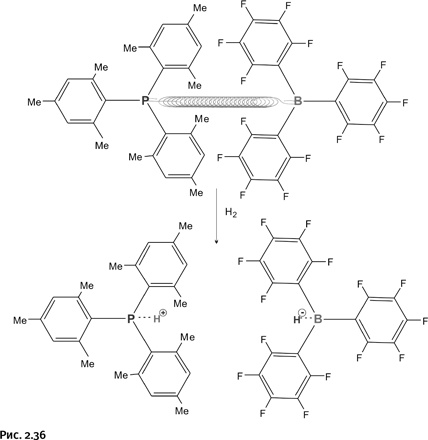
Пожалуй, главное в протекающей реакции то, что после присоединения водорода каждый из двух атомов (Р и В) «утоляет» свою донорное (или акцепторное) стремление, в результате напряжение спадает, что можно условно изобразить схемой (рис. 2.37). 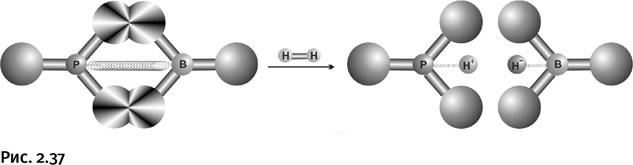
Обе части пары слегка отходят друг от друга, но недалеко, поскольку теперь они несут противоположные заряды, что позволяет им с помощью электростатических сил держаться вместе. Реакция обратима, при комнатной температуре водород присоединяется, а при 150 °С вновь выделяется, причем это можно даже наблюдать визуально: соединение с ионами водорода бесцветно, но если его нагреть, то выделится Н2, а оставшееся вещество приобретет красный цвет (рис. 2.38). 
Стефан изучил несколько вариантов таких «энергичных» пар (рис. 2.39). 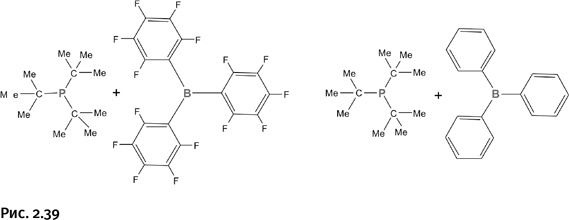
Все они присоединяют молекулярный водород, расщепляя его на ионы. Если принять во внимание, что в наше время постоянно обсуждают вопросы водородной энергетики, то на первый взгляд кажется, что одна из проблем решена – найдена хорошая «емкость» для хранения водорода. Однако для такого применения здесь слишком невыгодное соотношение масс: контейнер в 380 раз тяжелее содержимого (по соотношению атомных масс). Пока что проще и дешевле хранить водород в стальных баллонах под давлением или в созданных недавно ажурных молекулярных контейнерах, о которых рассказано в главе «Наилегчайшие вещества». Тем не менее полученный Стефаном результат впечатляет, разрыв связи Н – Н на ионы при комнатной температуре и в отсутствие металлсодержащих катализаторов – факт весьма необычный. «Озадаченные» комплексы Все рассмотренные нами пары с увеличенными пространственными затруднениями Стефан назвал frustrated lewis pairs. Интересно, что помимо пространственных возникли затруднения несколько иного рода. Здесь, пожалуй, уместно будет немного остановиться на вопросах терминологии. Два последних слова из предложенного английского названия особых вопросов не вызывают, это льюисовы пары, зато с первым термином не все гладко. Английское слово frustration (фрустрация) не имеет однозначного перевода на русский язык, приблизительно это огорчение, смущение, недоумение, расстройство, озадаченность, тщетное ожидание. Довольно часто иностранные термины используют в русской научной литературе без перевода, но в нашем случае сложность состоит в том, что из существительного «фрустрация» необходимо сделать прилагательное (как у Стефана), и здесь русский язык начинает сопротивляться. Маловероятно, что кто-то станет употреблять слова «фрустральный» или «фрустратный», они трудно произносимы и неблагозвучны. Наиболее близкое по смыслу слово – «озадаченный», именно оно стоит в заголовке этого раздела главы. Какой именно термин будет выбран окончательно, покажет будущее, важно лишь, чтобы он стал общеупотребимым, иначе в публикациях возникнут путаница и неясность. Интересно, что термин «фрустрация» (в форме существительного) часто используют психиатры для обозначения состояния, предшествующего нервному расстройству. Далее мы будем использовать название «озадаченные льюисовы пары» и соответствующее сокращение ОЛП. Горизонты ОЛП Вполне естественно, к изучению соединений со столь интересными свойствами подключились другие исследователи, создавая для ожидаемых льюисовых пар необычные пространственные ситуации. Чтобы о них рассказать более подробно, мы ниже вместо объемистых структурных формул будем использовать более компактное написание молекул: R3P и R′3B. Одна из идей состояла в том, чтобы связать компоненты таких пар в одну молекулу с помощью гибкого мостика – СН2–СН2–, в результате фрагменты с атомами Р и В, находящиеся на концах подобной перемычки, могут свободно поворачиваться. Вполне естественно, соединение приняло такую форму, в которой атомы Р и В расположились по возможности ближе друг к другу, однако эта форма несколько напряжена из-за того, что крупные группы у фосфора и бора приблизились и создали пространственные затруднения. Как только в систему добавили водород, он присоединился по той схеме, что была рассмотрена выше. При этом молекула развернулась таким образом, чтобы отвести друг от друга объемные группы и тем самым снизить напряжение (рис. 2.40). 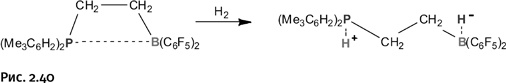
Некоторые исследователи при составлении таких пар в качестве борорганического соединения использовали многократно проверенный Стефаном B(C6F5)3, однако в качестве акцептора помимо бора успешно может работать алюминий, окруженный, естественно, объемными группами, оттягивающими к тому же электроны, – Al(C6F5)3. Атом фосфора, окруженный объемными группами, «приделывали» к ароматическим системам, к комплексам железа или циркония. Были изучены также пары, где вместо фосфора роль донора электронов играет азот. Все такие пары исправно присоединяли Н2 по уже рассмотренной нами схеме, и в результате общая картина заметно расширилась. Создан новый катализ Прочтя все описанное, некоторые из читателей, возможно, подумают, что это явление, безусловно, интересное, но сводится оно, по существу, только к присоединению водорода. На самом деле происходящий ионный разрыв связи Н – Н открывает новые возможности, что сумел показать создатель таких необычных льюисовых пар Стефан, а следом за ним и другие исследователи, увлеченные подобными химическими «дуэтами». Присоединение водорода к кратным связям в молекуле – гидрирование – один из самых распространенных процессов в химической индустрии, по существу это важная стадия при получении многих продуктов: лекарств, пестицидов, пищевых добавок, витаминов. Гидрирование обычно проводят в присутствии катализаторов – веществ, которые ускоряют процесс (часто без них процесс вообще не идет, сами катализаторы в процессе реакции не расходуются). Наиболее известные катализаторы гидрирования – металлическая платина, а также комплексы родия и рутения, которые способны временно присоединять Н2, а затем отдавать его различным органическим молекулам. Платина, родий и рутений весьма дороги, однако в процессах гидрирования они пока незаменимы. Оказалось, что ОЛП тоже способны выступать в роли катализаторов гидрирования. В первую очередь это было проверено на таком процессе, который чаще всего используют при получении различных природных соединений. Речь идет о гидрировании двойной связи во фрагменте – N=C– (напомним, что соединения, содержащие такой фрагмент, называют иминами). ОЛП присоединяет Н2, а затем отдает его молекуле имина. Освободившаяся ОЛП может вновь присоединить Н2 и гидрировать следующую молекулу. Это классический катализ – соединение переносит реагент (Н2), но само не расходуется и вновь возвращается в процесс, что показано на рисунке 2.41 изогнутой стрелкой.
|
 Вернуться к просмотру книги
Вернуться к просмотру книги
 Перейти к Оглавлению
Перейти к Оглавлению
 Перейти к Примечанию
Перейти к Примечанию
 © 2020 LoveRead.ec - электронная библиотека в которой можно
© 2020 LoveRead.ec - электронная библиотека в которой можно